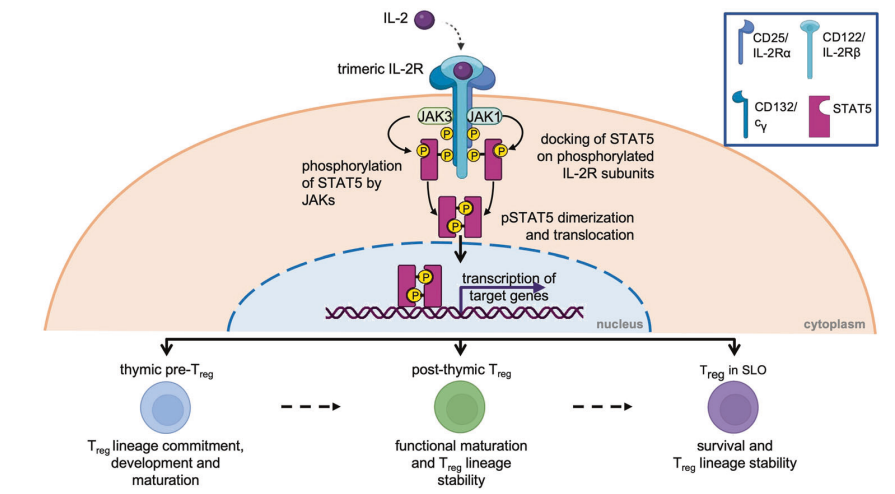
IL-2主要由活化的CD4+ T細(xì)胞產(chǎn)生的細(xì)胞,特別是Th1亞群�����。在胸腺和外周淋巴器官中���,IL-2信號(hào)通路通過(guò)與高親和力的IL-2受體(IL-2R)結(jié)合�,促進(jìn)Treg的分化和發(fā)育�����,導(dǎo)致T細(xì)胞中Foxp3基因表達(dá)的增加��,促進(jìn)了Foxp3+treg的分化��。當(dāng)IL-2與其受體結(jié)合時(shí)��,受體相關(guān)的JAK(特別是JAK1和JAK3)���,被激活�。JAK1與IL-2Rβ鏈相關(guān)����,而JAK3與IL-2Rγ鏈緊密相連。JAK激酶的激活是由它們的磷酸化啟動(dòng)的����,隨后使它們能夠磷酸化IL-2Rβ和其他下游信號(hào)分子��。這種磷酸化為包含SH2結(jié)構(gòu)域的信號(hào)分子創(chuàng)建了對(duì)接位點(diǎn)��。具體來(lái)說(shuō)����,STAT5被磷酸化的IL-2Rb鏈所吸引�。在STAT5家族中,有兩種不同的蛋白質(zhì)��,STAT5A和STAT5B���,它們都通過(guò)JAK激酶的作用進(jìn)行磷酸化�����。一旦磷酸化,STAT5蛋白形成同型二聚體或異型二聚體���,與受體分離����,并易位到細(xì)胞核�����,在那里它們與特定的DNA元件結(jié)合,促進(jìn)靶基因的轉(zhuǎn)錄)�����。IL-10是Treg產(chǎn)生的主要抑制性細(xì)胞因子���,同樣也會(huì)作用到Treg�。
IL-10由巨噬細(xì)胞�、單核細(xì)胞和T細(xì)胞產(chǎn)生,被認(rèn)為是Th2細(xì)胞因子和抗炎細(xì)胞因子��。IL-10分別通過(guò)JAK1和非受體酪氨酸蛋白激酶(Tyk2)磷酸化IL-10R1和IL-10R2的細(xì)胞質(zhì)尾部�����,從而誘導(dǎo)STAT3信號(hào)通路�����。雖然IL-10啟動(dòng)子缺乏Foxp3的結(jié)合位點(diǎn)��,但它確實(shí)包含STAT3的結(jié)合位點(diǎn)�,提示Foxp3可能通過(guò)STAT3信號(hào)通路間接調(diào)節(jié)IL-10的表達(dá)�。Foxp3通過(guò)組蛋白乙酰轉(zhuǎn)移酶(HATs)乙?��;疭TAT3����,參與了IL-10的轉(zhuǎn)錄激活��,形成了IL-10和Foxp3之間最重要的聯(lián)系�����。雖然IL-10信號(hào)通路并不需要誘導(dǎo)treg����,但它是treg介導(dǎo)其抑制功能所必需的。IL-6是一種與自身免疫性疾病和炎癥性疾病相關(guān)的炎癥細(xì)胞因子�。它可以由淋巴細(xì)胞和一些非淋巴細(xì)胞產(chǎn)生�。它也可以由成纖維細(xì)胞、內(nèi)皮細(xì)胞�、角質(zhì)形成細(xì)胞、系膜細(xì)胞和腫瘤細(xì)胞分泌����。IL-6的促炎特性包括抑制treg的免疫抑制能力和干擾它們從初始T細(xì)胞中的分化����。研究表明����,高水平的IL-6和IFN-γ抑制了treg分化過(guò)程中Foxp3的表達(dá)。當(dāng)IL-6存在于炎癥部位�����,如黏膜炎癥部位時(shí)����,它可以通過(guò)酪氨酸導(dǎo)致下游STAT3的磷酸化,p-STAT3的高活性可增加T細(xì)胞中轉(zhuǎn)錄因子RORgt的表達(dá)�,進(jìn)而降低Foxp3的表達(dá),從而導(dǎo)致CD4+ T細(xì)胞分化為T(mén)h17細(xì)胞����,而不是treg細(xì)胞。TGF-b是一種由巨噬細(xì)胞和T細(xì)胞產(chǎn)生的多功能細(xì)胞因子��,在免疫調(diào)節(jié)中起著關(guān)鍵作用����。TGF-b主要通過(guò)調(diào)節(jié)T細(xì)胞亞群的發(fā)育和功能來(lái)發(fā)揮其免疫調(diào)節(jié)作用�。TGF-b通過(guò)激活SMAD信號(hào)通路的抑制因子�����,誘導(dǎo)treg的關(guān)鍵轉(zhuǎn)錄因子Foxp3的表達(dá)�����,這促進(jìn)了treg的產(chǎn)生�,從而抑制炎癥和防止自身免疫反應(yīng)。TGF-b家族成員與受體作為配體合作形成受體復(fù)合物����,激活受體調(diào)控的SMAD(R-SMAD),該SMAD與共同介質(zhì)SMAD(Co-SMAD)合作進(jìn)入細(xì)胞核�。通過(guò)識(shí)別不同的SMAD結(jié)合蛋白并形成復(fù)合物,調(diào)控不同靶基因的特異性表達(dá)�,最終發(fā)生TGF-b的多種生物學(xué)效應(yīng)。
SMAD蛋白家族是第一組參與TGF-b信號(hào)轉(zhuǎn)導(dǎo)的信號(hào)分子���,該信號(hào)通路受到抑制性SMAD(I-SMAD�����,即SMAD6和SMAD7)的嚴(yán)格調(diào)控�����。SMAD6和SMAD7的n端結(jié)構(gòu)域僅具有37%的同源性��,而含有SMAD7N-端結(jié)構(gòu)域和SMAD6 MH2結(jié)構(gòu)域的嵌合體對(duì)TGF-b信號(hào)通路的抑制方式與SMAD7相同�����。SMAD6傾向于抑制BMPI型受體ALK-3和ALK-6誘導(dǎo)的信號(hào)通路��。
TGF-b在Treg和Th17細(xì)胞分化的平衡中也起著重要的調(diào)控作用���。內(nèi)源性TGF-b與炎癥介質(zhì)如IL-6、IL-21和IL-23��,一起抑制Foxp3的表達(dá)�����,并啟動(dòng)RORgt介導(dǎo)的Th17細(xì)胞的分化途徑�����。隨著炎癥后期IL-6水平下降,TGF-b單獨(dú)促進(jìn)Foxp3的表達(dá)促進(jìn)Treg分化���,抑制RORgt限制Th17細(xì)胞��,從而維持Treg功能���,控制效應(yīng)細(xì)胞反應(yīng)的終止。TNF-a是一種炎癥細(xì)胞因子���,介導(dǎo)炎癥�����,并可能導(dǎo)致組織損傷�����。它由巨噬細(xì)胞����、單核細(xì)胞�����、中性粒細(xì)胞、CD4+ T細(xì)胞和NK細(xì)胞分泌���。雖然TNF-a通常以增強(qiáng)免疫反應(yīng)和促進(jìn)炎癥,但它也被證明抑制Treg功能��。TNF-a抑制treg的分化和發(fā)育�,導(dǎo)致其數(shù)量的減少。在Treg分化過(guò)程中�,TNF-a的存在干擾了TGF-b信號(hào)通路。這涉及到破壞下游信號(hào)分子的激活和轉(zhuǎn)導(dǎo)�,如SMAD蛋白家族的磷酸化和核易位,進(jìn)而影響Foxp3的表達(dá)和Treg分化�����。與傳統(tǒng)的CD4單陽(yáng)性細(xì)胞相比����,TNF受體超家族成員,包括糖皮質(zhì)激素誘導(dǎo)的TNFR相關(guān)(GITR)�、CD134和TNFR2,在Treg前體細(xì)胞上過(guò)表達(dá)��。這些受體通過(guò)TGF-b激活的激酶1(TAK1)和CD28依賴(lài)的信號(hào)通路增強(qiáng)T細(xì)胞受體(TCR)信號(hào)通路����。缺乏TAK1和CD28的Treg前體細(xì)胞不能表達(dá)GITR����、CD134或TNFR2����,從而導(dǎo)致Foxp3+ Treg成熟的抑制。IL-35是IL-12家族的一個(gè)成員��,是一種由p35和ep病毒誘導(dǎo)的基因3(EBI3)組成的異二聚體蛋白�����,它可以由Tregs分泌�����。IL-35可在各種組織和環(huán)境中表達(dá)���,如胸腺�、周?chē)馨推鞴俸脱装Y部位�����,并通過(guò)激活I(lǐng)L-35受體(IL-35R)來(lái)影響treg的產(chǎn)生和維持。IL-35不僅抑制效應(yīng)T細(xì)胞��,還促進(jìn)CD4+ T細(xì)胞轉(zhuǎn)化為產(chǎn)生il35的誘導(dǎo)調(diào)節(jié)性T細(xì)胞(iTr35)�。IL-35通過(guò)與IL-35R結(jié)合來(lái)觸發(fā)信號(hào)轉(zhuǎn)導(dǎo),IL-35R由兩個(gè)亞基(即IL12 Rb2和IL-27Ra)組成��,隨后激活JAK1和Tyk2激酶��,并激活STAT蛋白�����,包括STAT1和STAT4�����,形成二聚體或多聚體���,然后易位到細(xì)胞核,在那里它們可以激活Foxp3的轉(zhuǎn)錄��。此外����,IL-4的研究結(jié)果有些不同�。一開(kāi)始�,在IL-4R缺陷小鼠,發(fā)現(xiàn)Treg的數(shù)量并無(wú)減少��,被認(rèn)為IL-4對(duì)于Treg的發(fā)育不重要�����。但是后來(lái)發(fā)現(xiàn)����,IL-4可以促進(jìn)部分tTreg前體細(xì)胞生成tTreg細(xì)胞。Owen DL, Mahmud SA, Sjaastad LE, Williams JB, Spanier JA, Simeonov DR, et al. Thymic Regulatory T Cells Arise via Two Distinct Developmental Programs. Nat Immunol (2019) 20(2):195–205. doi: 10.1038/s41590-018- 0289-6參考資料
Zong Y, Deng K and Chong WP (2024) Regulation of Treg cells by cytokine signaling and co-stimulatory molecules. Front. Immunol. 15:1387975. doi: 10.3389/fimmu.2024.1387975Zhang W, Liu X, Zhu Y, Liu X, Gu Y, Dai X, et al. Transcriptional and posttranslational regulation of th17/treg balance in health and disease. Eur J Immunol. (2021) 51:2137–50. doi: 10.1002/eji.202048794Itoh S, ten Dijke P. Negative regulation of tgf-beta receptor/smad signal transduction. Curr Opin Cell Biol. (2007) 19:176–84. doi: 10.1016/j.ceb.2007.02.015
Valentina Lykhopiy et al, "IL-2 immunotherapy for targeting regulatory T cells in autoimmunity", Genes Immun. 2023 Oct;24(5):248-262. doi: 10.1038/s41435-023-00221-y. Epub 2023 Sep 23.