首頁
>
新聞資訊
>
正文
T細(xì)胞運動的5個驅(qū)動因素
2024-08-15 點擊量:603
炎癥組織中白細(xì)胞的三維運動是受組織ECM�����、趨化信號、粘附信號的可用性和分布的調(diào)控�����。這些引導(dǎo)線索之間的平衡將決定最有效的遷移模式���。1. 趨化因子
趨化因子在T細(xì)胞招募的組織特異性和選擇性中起著核心作用�。它們通過與GPCRs結(jié)合來引導(dǎo)遷移。GPCRs啟動信號級聯(lián)���,激活整合素并調(diào)節(jié)肌動蛋白細(xì)胞骨架的重構(gòu)���。最初的T細(xì)胞進(jìn)入炎癥組織,或跨內(nèi)皮遷移(TEM)�����,是由內(nèi)皮細(xì)胞和糖萼表面的固定的趨化因子引導(dǎo)的��。儲存在內(nèi)皮細(xì)胞胞內(nèi)囊泡中的內(nèi)皮內(nèi)趨化因子可以引導(dǎo)TEM�。趨化因子的固定化是通過與磺化糖胺聚糖(GAGs)結(jié)合來實現(xiàn)的,如硫酸肝素�,它們共價地附著在內(nèi)皮細(xì)胞相關(guān)的基質(zhì)上。GAGs是一種帶負(fù)電荷的線性多糖,由于其長度�����、組成和乙?��;突腔J降牟煌?/strong>����,具有令人難以置信的多樣性��。它們能夠與趨化因子等其他帶電分子相互作用�,這使它們成為趨化劑可用性和穩(wěn)定性的關(guān)鍵調(diào)節(jié)因子,從而塑造了趨化因子梯度的性質(zhì)��。內(nèi)皮細(xì)胞頂端和基底外側(cè)之間的硫酸肝素的陡峭梯度為內(nèi)皮細(xì)胞和周細(xì)胞釋放的趨化因子的趨化梯度模式提供了一種機(jī)制��,這可以驅(qū)動TEM的定向遷移����。需要注意的是,免疫細(xì)胞可以通過非血管途徑進(jìn)入某些內(nèi)臟器官���,并可能受到不同的組織進(jìn)入機(jī)制的調(diào)節(jié)�����。在組織中��,有各種各樣的GAG主要附著在ECM的核心蛋白上(肝素/硫酸肝素��、硫酸軟骨素/硫酸皮膚蛋白����、硫酸角蛋白和透明質(zhì)酸),盡管透明質(zhì)酸也可以被發(fā)現(xiàn)“游離”或非ECM結(jié)合���。這些GAG的表達(dá)水平在炎癥組織、慢性感染和自身免疫中顯著增加�。趨化因子的突變降低了它們與GAG結(jié)合的能力,使白細(xì)胞遷移消失����,這突出了趨化因子-GAG相互作用的重要性。趨化因子可能存在于可溶性和GAG結(jié)合形式之間的動態(tài)平衡中�����,并會根據(jù)特定的寡聚狀態(tài)而變化����。越來越多的證據(jù)表明�,介導(dǎo)受體相互作用的趨化因子信號殘基也參與了GAG結(jié)合�,這表明GAG結(jié)合的趨化因子可能不能直接激活遷移白細(xì)胞的受體。相反�����,趨化因子-GAG結(jié)合可能在炎癥組織中作為一個局部儲存庫���,以保持趨化因子的顯微解剖位置和壽命���,否則趨化因子很容易從誘導(dǎo)部位擴(kuò)散出去。GAG中趨化因子的釋放是如何被調(diào)節(jié)以告知細(xì)胞遷移的����,目前還不清楚。在炎癥過程中���,GAG可以通過肝素酶等酶從其蛋白聚糖主干中釋放出來�,這可能會改變與游離趨化因子的結(jié)合的比例�。新釋放的可溶性趨化因子可能有助于趨化性的局部微調(diào)以調(diào)節(jié)細(xì)胞運輸,盡管這尚未為白細(xì)胞遷移得到證明��。淋巴細(xì)胞表達(dá)大量的整合素,介導(dǎo)細(xì)胞-細(xì)胞和細(xì)胞-基質(zhì)之間的相互作用����。效應(yīng)T細(xì)胞上的LFA1(αLβ1)和VLA4(α4β1)整合素分別通過與ICAM1和VCAM1結(jié)合來介導(dǎo)TEM,這兩種整合素在炎癥組織的血管內(nèi)皮上表達(dá)上調(diào)�。一旦進(jìn)入組織內(nèi),基質(zhì)結(jié)合整合素的表達(dá)可以促進(jìn)與ECM的相互作用�,并控制炎癥部位的遷移和定位(見下文中的ECM的物理和力學(xué)特性部分)。特異性是由α和β亞基配對決定���,這些整合素結(jié)合許多ECM蛋白質(zhì):如層粘蛋白(α1β1��,α2β1����,α3β1���,α5β1,αVβ1/β3���,α6β1�����,α7β1)���,纖維膠原(α2β1��,α3β1)����,Arg-GlyAsp(RGD)基序包含在許多ECM蛋白質(zhì)�,例如纖維連接蛋白和層粘連蛋白(α5β1,αVβ3���,αVβ5����,αIIbβ3)�����,和蛋白質(zhì)表達(dá)的組織屏障���,例如鈣粘蛋白(αEβ7)���。整合素結(jié)合的親和力可以通過細(xì)胞外線索來增強(qiáng)�,如趨化因子依賴的構(gòu)象變化和增加的配體誘導(dǎo)的聚集���。整合素的大型局灶粘連似乎與T細(xì)胞展示的阿米巴快速遷移不相容���。值得注意的是,盡管在沒有整合素的情況下有可能移動���,但在正常生理和病理條件下�����,主動遷移的白細(xì)胞不太可能不斷地暴露于整合素配體��。T細(xì)胞在面對壓倒性的配體和趨化因子激活信號時��,如何調(diào)整它們對這種整合素結(jié)合活性的敏感性����,目前還不清楚�����。主動遷移的T細(xì)胞可能形成小的��、高度動態(tài)的局灶粘連��,提供足夠的摩擦力���,使細(xì)胞在整合素介導(dǎo)和非整合素介導(dǎo)的細(xì)胞遷移模式之間快速來回移動�,以優(yōu)化速度和組織覆蓋�。如果不是間質(zhì)遷移本身所必需的,整合素配體提供了重要的定位信號���。穿過基底膜是白細(xì)胞組織進(jìn)入的限速步驟��?����;啄さ慕M成隨著毛細(xì)血管后小靜脈的長度而變化�����,可以決定組織進(jìn)入�����,低層粘連蛋白α5位點是CD4+ T細(xì)胞(表達(dá)α6β1 integrin)進(jìn)入中樞神經(jīng)系統(tǒng)的首選位點�����。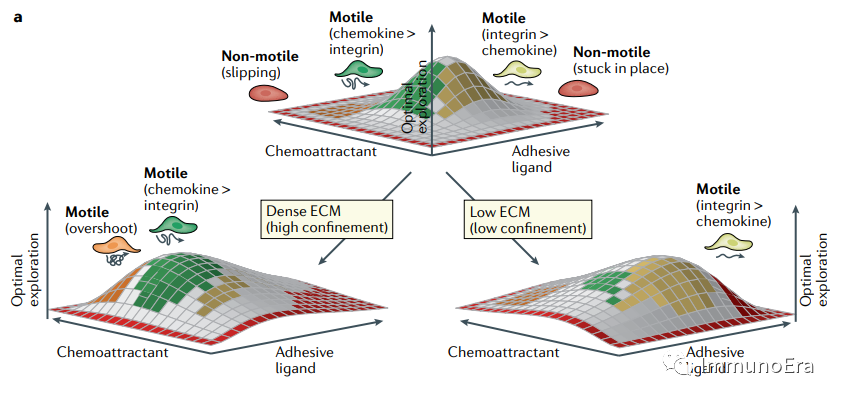
ECM 3D超微結(jié)構(gòu)提供了一個物理支架����,促進(jìn)或限制對炎癥組織區(qū)域的進(jìn)入,并作為呈現(xiàn)趨化信號(如上所述)和生長因子的動態(tài)平臺�。細(xì)胞因子,如腫瘤壞死因子(TNF)���、干擾素-γ(IFNγ)和轉(zhuǎn)化生長因子-β(TGFβ)�,以及炎癥組織中釋放的蛋白酶調(diào)節(jié)ECM密度�����、組成和“剛度”�。因此,遷移的白細(xì)胞面臨著一個高度可變的炎癥環(huán)境�����。然而�,由于無法實時可視化觀察細(xì)胞外基質(zhì)和遷移的T細(xì)胞�,無法了解T細(xì)胞是否直接與基質(zhì)連接�、在附著在基質(zhì)上的細(xì)胞上移動還是在細(xì)胞之間移動的基本問題也沒有得到解決����。炎癥還可以改變組織基質(zhì)的剛度或彈性,影響在T細(xì)胞遷移時施加的機(jī)械力�����,以及用于感知這種變化的受體�����,這一過程被稱為機(jī)械感應(yīng)���。一般來說��,由于從軟到硬的基質(zhì)的牽引力增加���,細(xì)胞傾向于向更硬的環(huán)境移動。炎癥組織中的T細(xì)胞遷移是由正遷移信號和負(fù)阻滯信號之間的平衡形成的�,通常被認(rèn)為是T細(xì)胞受體(TCR)(“stop”)和趨化因子(“go”)信號強(qiáng)度之間的平衡。這種競爭在體外得到了很好的證明����,其中TCR誘導(dǎo)的遷移阻滯可以被一些(但不是所有的)趨化因子信號所覆蓋��。T細(xì)胞阻滯依賴于LFA1-ICAM1介導(dǎo)的粘附和TCR信號�����,導(dǎo)致前沿肌動蛋白細(xì)胞骨架的快速變化�����,微管組織中心的重新定位���,并在T細(xì)胞和APC之間的界面形成穩(wěn)定的免疫突觸。在分子水平上����,目前尚不清楚停止和去信號是如何被優(yōu)先排序的,因為TCR和趨化因子受體通常共享共同的下游信號中間體����。在炎癥部位,APC表面的同源抗原-MHC復(fù)合物是一個強(qiáng)大的停止信號����。
生物活性脂質(zhì)對T細(xì)胞遷移的控制����,主要是在淋巴結(jié)(和組織)的淋巴管出口��,最為著名的是淋巴管中鞘氨醇-1-磷酸鹽(S1P)梯度�����,可被活化T細(xì)胞上表達(dá)的GPCR鞘氨醇-1-磷酸鹽受體(S1PR1)感知��。炎癥誘導(dǎo)的白三烯��,特別是白三烯B4(LTB4)��,是白細(xì)胞的有效趨化劑����。同時��,高親和力的LTB4受體BLT1在T細(xì)胞分化過程中表達(dá)上調(diào)����。這些脂質(zhì)趨化劑可以在幾分鐘內(nèi)產(chǎn)生,并且具有高度擴(kuò)散��;因此,它們的可用性和組織覆蓋可能比在環(huán)境中靶向生產(chǎn)趨化因子更普遍�����。通過對淋巴結(jié)生發(fā)中心動力學(xué)的研究�����,人們發(fā)現(xiàn)了許多在免疫引導(dǎo)和定位方面的新參與者����,其中TFH細(xì)胞和B細(xì)胞在生發(fā)中心內(nèi)的定位和保留對于高親和力抗體分泌細(xì)胞的成功發(fā)展至關(guān)重要。生發(fā)中心的組織部分由卵泡邊緣的氧化甾醇配體引導(dǎo)���,結(jié)合TFH細(xì)胞和B細(xì)胞表達(dá)GPCREBI288����。- Fowell DJ, et al. The spatio-temporal control of effector T cell migration���,https://doi.org/10.1038/s41577-021-00507-0
- McFarland, A. P. & Colonna, M. Sense and immuno sensibility: innate lymphoid cell niches and circuits. Curr. Opin. Immunol. 62, 9–14 (2020)
- Reversat, A. et al. Cellular locomotion using environmental topography. Nature 582, 582–585 (2020)
亚洲永久精品一二三区|
97久草青青视频|
18禁网站禁片免费观看|
91人人妻人人澡人人爽精品|
婷婷五月六月在线中文字幕|
蜜桃av视频一区二区|
91久久精品曰曰躁夜夜躁国产|
国产亚洲欧美另类中文91|
黑毛毛一区二区|
青青草国产娱乐乱伦视频|
国产剧情主播自拍av|
波多野结衣乳巨码无银杏TV
|
国产精品白浆流出在线观看|
护士sex性hd性生话|
精品久久精品|
亚洲精品无码成人片|
豆花无码视频一区二区|
国产V日韩V亚洲欧美久久|
国产欧美日韩黄片|
在线观看无码流出国内|
骚女视频成人版在线观看|
韩国婬乱高潮AAAA片|
狠狠综合久久久久|
太紧太爽太黄太粗太大|
成人免费在线黄色|
日本试看一区二区|
亚洲 日本 欧美 中文幕www|
WWW.黄色三级网站|
欧美V?亚洲V?在线观看日本|
5278欧美一区二区三区|
精品国产乱伦一区二区三区|
边摸边吃奶边做动态图|
亚洲制服丝袜无码a∨在线|
国产精品先锋资源站先锋影院|
亚洲国产午夜精品理论片妓女|
蜜臀?v午夜福利在线观看|
精品国产另类AⅤ一区二区|
99国产精品白浆无码流出|
免费无码va一区二区三|
亚洲高清无码不卡一区免费在线
|
亚洲AV无码一区二区三区欢看|
j8又粗又硬又大又爽又长|
亚洲成AV人综合在线观看|
日韩美女喷水大片在线观看|
在线国产一区a一级毛片|
亚洲熟妇无码一二三|
欧美人与动牲交AⅤ|
成人白浆超碰人人人人|
99久久999久久久综合精品|
国产不卡一卡2卡三卡4卡5卡在线|
久久久久国产毛片高清|
亚洲一级特黄大片av|
AV美女免费看美女免费看|
免费日韩在线观看一区|
91麻豆精品在线播放|
日本免费一区二区三区视频|
无码一区二区aⅤ网|
蜜臀成人片免费视频在线观看
|
男女视频资源免费观看|
A级毛片免费看在线看|
丝袜人妻无码在线|
亚洲成AV人综合在线观看|
国产区拍精品亚洲|
538高清无码在线网站|
国产精品成人精品一区二区
|
av天堂亚洲国产av|
啦啦啦在线视频免费观看
|
成人淫片视频99|
国产综合五月婷婷|
欧美在线一级a级在线视频|
亚洲成AV人片在线观看天堂无
|
成年拍拍拍免费视频网站|
激情都市综亚洲精品综合|
一区二区美女操比|
欧美在线观看免费专区|
国产亚洲福利蜜臀|
亚洲欧洲日产国码Aⅴ系列天堂|
亞洲視頻三區|
粉嫩AV在线免费观看|
精品亚洲一区二区中文字幕|
精品亚洲成?人片在线观看|
污污香蕉视频在线观看|
国产欧美∨a欧美∨a香蕉在|
国产精品偷伦视频免费呦|
少妇人妻无套进入69va|
久久夜夜亚洲一区|
18免费污污网站|
一道本伊人一区二区三区日日日|
农村中国幻女4一6特级毛片|
国产性夜夜性夜夜爽丁香|
污黄黄色毛片网站在线观看|
欧美综合在线24p不卡|
久久久特级无码AV二区免费看|
九一视频国产欧美日韩|
美女裸体网站免费网站免费网站免费|
日韩理论片午夜无码|
欧美性爱一级片中文字幕|
亚洲毛片无码专区亚洲|
日本久久精品免费一区|
亚洲中文字幕不卡一区二区三区
|
不卡中文1区2区|
美女MMM131爽爽爽免费|
91精品国产探花|
日韩成人无码电影观看网站免费下载|
丰满少妇猛烈进入A片高潮|
亚洲精品无码免费观看|
日本午夜福利精品|
成品网站W灬源码1688伊|
亚洲精品在线网站|
东京热久久岛国综合无码人妻|
日本亚洲欧洲免费中文字幕|
成人影片在线免费观看|
三个领导换着躁我几小时在线观看|
国产精品va无码一区二区在线观看|
日韩毛片免费av|
久久国产精品午夜激情在线播放|
国产亚洲精品在人成网在线|
呦系列视频一区二区三区软件|
国产日产亚洲精品系列最新av|
久久亚洲?V成人无码国产|
久久久久久久久久久久久久|
91精品国产在拍自线|
国产免费无码爽刺激|
黄片免费在线播放|
在线观看污片|
亚洲Av无码成人精品去狼人影院|
好色先生软件免费下载|
欧美劲爆色情av播放|
女人的奶头(无遮掩)视频|
国产成人啪精品视频免费网麻豆|
成人免费在线黄色|
亚洲无码毛片免费视频在线观看|
亚洲欧美日韩中文视频专区|
亚洲乱熟女av一区二区三区|
免费三级亚洲人成|
无码经典电影大全免费全集在线观看|
欧美日韩国产综合片区|
岛国免费一区二区三区视频|
免费又色又爽又黄的视频入口|
2018天天看夜夜操狠狠操|
性猛交xxxxx按摩欧美|
新版天堂资源中文在线|
成人精品一区二区三区中文
|
天天艹天天射|
国产日本欧美一区二区三区|
久久久久麻豆av|
亚洲va欧美va国产va|
香蕉视频一区二区|
在线看片免人成视频国产|
最新福利视频午夜|
a片试看120分钟做受图片|
香蕉色视频在线观看|
国产手机?V片在线无码观你|
久久精品电影久久久精品|
九色成人蝌蚪电影在线|
国产欧美日韩黄片|
无码纯肉视频在线观看免费|
国产色网三级片在线观看|
AV美女免费看美女免费看|
亚洲AV无码精品网站色欲AV|
avtt免费播放一区二区三区|
丝袜制服第57页中文字幕|
亚洲一区二区三区日韩精品|
国产黄片高清无码在线观看|
中文字幕有码免费一区二区
|
91短视频APP在线观看|
无码久久精品国产亚洲?v影片
|
国产一三级片精品字幕|
成年污片免费视频网站|
国产黄片的免费看|
成人精品欧美一级乱黄欧美|
亚洲色区一区|
亚洲精品无码九九九九九|
人妻暴雨中被强制侵犯|
亚洲欧美制服三级另类|
麻花豆传媒MV在线观看软件|
国产综合A∨一区二区三区无码|
亚洲性日韩精品一区二区|
在线 不卡 免费 欧美|
日本亚洲精品黄色|
一本久道综合久久精品|
国产偷情小视频精品二三区|
a级毛片高清免费视频中文|
538prom国产一区二区三区
|
欧美视频日韩电影|
亚洲国产综合久久灌醉|
欧美日韩国产激情在线视频|
婷婷的久久五月综合先锋影音|
一本九中文字幕在线播放|
91短视频APP在线观看|
欧美劲爆色情av播放|
国产精品自拍亚洲|
性猛交xxxxx按摩欧美|
国产真实迷jian系列在线网站|
黄片免费在线播放|
日本高清不卡免费|
日韩欧美国产中字|
欧美日韩国产精品合集|
亚洲国产黄片亚洲性爱自拍|
韩国婬乱高潮AAAA片|
国产美女精品自在线拍电影|
97爱人妻免费公开视频|
全国三级网站免费观看|
毛片网站大全在线免费观看|
伊人成色综合人夜夜久久|
推荐国产福利一区二区三区在线视频|
婷婷五月六月在线中文字幕|
最新国产一区二区在线|
亚洲毛片无码专区亚洲|
中文在线日韩乱码不卡视频|
欧美伦理一区二区三区电影|
免费 无码 国产在线观看观12|
酒店玩弄漂亮少妇高潮|
欧美三级在线观看少妇|
a毛片视频免费观看|
欧美日韩精品第一区二区|
国产熟女一区二区精品视频|
精品午夜精品一区二区三区|
午夜性开放A级视频|
精品国产成人一区二区|
午夜免费av在线|
亚洲国产精品色一区二区三区麻豆|
天天躁日日躁狠狠躁AV中文|
欧美专区日韩高清|
精品久久久久久一区二区r|
午夜亚洲av永久无码精品动漫|
国产毛片健身在线|
边做边爱完整版免费视频播放茄子|
青青青爽免费视频在线观看|
久久久久久久亚洲视频|
国产 日韩 欧美 亚洲|
337p69日本欧洲亚洲大胆艺术|
a97se亚洲国产综合自在线|
97色色亚洲日韩色|
亚洲老熟妇老熟女1|
国产一区二区精品久久久蜜臀|
欧美劲爆色情av播放|
麻豆国产传媒片在线看|
大色网小色网淫色网|
午夜伦欧美理片848|
国产色极品女人在线视频|
国产成人无码区在线观看流畅|
自拍偷拍欧美专区|
免费人成无码视频在线不卡|
果冻传媒九一制片厂|
五月六月婷婷性综合|
呦系列视频一区二区三区软件|
日本亚洲精品黄色|
av无码在线播放|
亚洲成精品自拍|
欧美成人在线免费观看|
99久久精品免费看国产免费|
特级黄片免费观看一区二区三区|
窝窝社区情涩网麻烦欧美97|
亚洲gv无码成人污在线观看|
精品国产v无码大片在|
国产精品性爱亚洲黄片大全|
自拍影视综合欧美|
成人亚洲无码观看日韩涩涩高清|
jizz在线观看免费高清|
久久国产精品一区免费观看|
欧洲最强RAPPER潮水喷|
超清制服丝袜无码αv福利网|
国产日韩欧美有码|
国色天香社区视频在线观看完整版|
日韩在线视频一区二区三区|
99精品视频只99有精品|
工口里番污肉全彩acg资源|
好男人资源在线观看播放视频网|
亚洲黄色毛片视频在线免费看|
4480yy亚洲成年私人影院|
成激情人妻视频|
欧美亚洲国产日韩不卡|
国产gaysexchain男同men高清
|
久久夜色国产精品噜噜|
曰本a级毛片无卡免费|
爱情岛网站亚洲禁18进入|
亚洲精品a区在线|
综合图区亚洲性爱|
亚洲av中文无码字幕色最新|
亚洲第一影院在线播放|
人妻无码系列一区精品|
亚洲?v成人精品二区|
免费无码国产v片在线观看无遮拦
欧美另类亚洲视频二区
|
蜜桃视频高清在线观看|
一起草成人免费AV|
国产在线视频无遮挡|
怡红院首页色网视频|
丰满少妇高潮抽出直播|
毛片无码专区精品一区|
亚洲天堂网在线观看视频|
无码纯肉视频在线观看免费|
国产成人年无码片在线观看
|
日韩在线观看视频区一区二|
黑人与中国少妇免费公开播放|
久久高清少妇三级|
影音先锋熟女少妇av资源|
97av视频在线播放|
一点不卡无码免费|
国产91网站在线观看免费|
亚洲人与动人物a级毛片一
|
国产一成人综合久久免费|
jizz在线观看免费高清|
哒哒哒免费视频观看在线www|
99久久无色码中文字幕人妻|
日本激情电影在线免费观看|
这里只有精品国产|
免费看干一级黄色|
免费v片无码动漫在线观看网址|
2024精品国产品免费观看
|
欧美日韩亚洲中文在线一区|
精品视频在线观看13p|
欧美精品久久天堂久久|
茄子短视频看黄专用|
大肉大捧一进一出视频出来呀|
日本高清www午色夜com|
99RE6热视频这里只精品首页|
一区二区自拍视频|
精品日本综合自拍|
欧美性爱视频人人看|
99热九九热精品在这里做|
久久久久噜噜噜亚洲熟女|
日本激情精品视频一二三观看|
呦系列视频一区二区三区软件
|
国产一级a作爱片全过程片52|
真人一级一级97一片a毛片|
爆操美女亚洲一区|
337p欧美日本超大胆艺术|
少妇无套内射免费观看视频|
深夜网站免费观看|
亚洲国产精品真实内射|
综合欧美日韩精品在线|
国产精品丝袜视频一区|
五月丁香久久激情亚洲动漫|
亚洲一区中文字幕在线电影网|
亚洲人成在线精品|
丁香六月亚洲婷婷|
正在播放国产一区二区|
午夜成人鲁丝片午夜精老熟女|
亚洲精品国偷拍自产|
手机在线观看你懂得|
免费v片在线播放|
AV天堂 热の中文 热の偷拍|
亚洲国产丝袜精品久久久一区二区|
91丨PORNY丨国产入口|
美国一级毛片在线|
亚洲一区二区三区av免费|
60后老熟妇乱子伦视频|
女人高潮流免费观看视|
国产韩国日本在线播放|
亚洲日韩精品看片无码久久
|
国产剧情主播自拍av|
欧美图片电影天堂|
一本之道二区无码免费视频|
91精品国产探花|
免费曰b爽爽爽爽看|
日本69视频在线观看完整版|
精品亚州一区三区六区|
亚洲欧美国产成人久久|
无码熟妇αⅴ人妻又粗又大
|
日韩高清久久av|
护士sex性hd性生话|
成人无码免费视频啊啊啊|
日本中文字幕色网|
国产午夜草莓视频在线观看色香天天影视来吧综
|
免费特级一级作爱片|
国产毛片健身在线|
久久99人妻精品涩爱噜噜噜蜜臀
|
人无码aⅴ片在线观看|
新play精品视频免费观看|
女自慰喷水精品www久久久|
久久综合色中文字幕|
骚女后入国产日韩在线播放|
国产三级在线线看免费|
久久天天躁狠狠躁夜夜av不卡|
国产精品鲁鲁视频|
汤唯被揉到高潮下不了床视频|
果冻传媒乱码一区|
国产精品六区九九综合亚洲|
外国亚洲三级在线|
国产黄a一级二级三级久久av免费观看
|
娇小的学生videos16日本|
国产日韩黄色大片|
女人19水真多免费毛片|
青青青爽免费视频在线观看|
国产99视频精品免费视频6互動交流|
在线亚洲欧美日韩精品|
a片试看120分钟做受图片|
午夜影院网站推荐|
首播私人影院国产av|
免费AV永久免费网址|
国产区91桑拿会所技师|
人妻精品天天干夜夜爽|
5g影视大片天天免费观看|
国产精品色午夜视频免费看|
亚洲欧美经典国产|
中文字幕亚洲午夜骚|
在线免费观看黄色网站|
饥渴老熟妇女乱人伦视频|
538高清无码在线网站|
午夜精品尤物一区二区|
国产一区二区三区精品亚洲|
亚州一级高清AV毛片|
国产亚洲精品自|
免费看干一级黄色|
欧洲午夜精品|
97久久精品无码一区二区天|
中国老熟妇偷拍视频|
国产成人无码区在线观看流畅|
啪啪啪视频国产中文字幕|
日本美女18禁网站免费观看|
青青青草原亚洲综合|
一级国产手机在线视频|
污网站免费观看永久免费|
国产精品丰满对白在线观看|
中日韩欧美美女在线观看一区|
伊人精品视频|
国产自慰免费在线看|
国产国内精婷婷综合网|
亚洲韩国欧美综合在线|
国产亚洲免费网站看日韩v片在线|
寡妇张开腿让黑人捅爽|
最新无码人妻在线视频|
久久久久中文无码精品|
国产亚洲精品a在线看|
欧美在线观看免费做受视频|
91香蕉视频下载污|
亚洲色网站在线观看|
睡眠性格指导1∽6集|
强制高潮18XXXX按摩它|
国产小伙嫖妓在线播放|
成年免费视频播放人69|
久久精品国产99国产精2021|
國產粉嫩00福利福利福利|
免费观看视频一区二区三区|
国产高清精品国语特黄A片|
国产三级在线线看免费|
百合女女互慰吃奶互揉网站|
99久久综合狠狠综合久久a真人一级a毛一级看免费视频
|
国产成人拍精品视频网址|
蜜桃aⅴ一区二区三区|
在线观看视频一欧美区|
日本高清中文在线|
日本精品第一色网在线|
无码专区久久综合|
国产成人特级a级毛片试看|
激情唯美欧美亚洲另类|
色亚洲中文字幕在线观看|
92看片婬黄大片一级|
在线观看视频一欧美区|
青青青爽在线视频观看|
男人的天堂久久精品激情a|
中国老太婆牲交真人视频|
黄色视频啪啪啪一区|
男人扎爽进女人j网站免费|
破处视频在线观看|
国产成人av专区|
亚洲男人色天堂|
男生女生一起差差差带疼痛的声音|
精品国产成人一区二区
|
女人裸体扒开下身照片无遮挡|
污污污网站在线观看91躁|
国产啪亚洲国产精品无码麻|
日韩一级AA大片免费视频|
一级aaa特黄av片免费|
综合在线观看免费自拍
|
亚洲欧美经典国产|
无码熟妇αⅴ人妻又粗又大
|
麻花豆传媒MV在线观看软件|
日韩欧美在线成人|
亚洲色中文字幕无码?V|
粉嫩AV在线免费观看|
熟女视频综合免费|
国产亚洲A v片天天在线观看
|
H无码中文字幕在线|
粗大猛烈进出高潮喷浆h|
国产精品亚洲啊V天堂兔|
精品无码啪啪|
一级毛片中文免费观看|
精品一区二区三区无码视频99|
警花av一区二区三区|
成人免费一区二区三区视频牛牛
|
毛片在线高清免费观看|
亚洲AV无码AV日韩红杏|
涩涩激情免费视频在线|
а√天堂在线观看免费|
欧美女人91成人网|
亚洲成a人片在线观看国产不卡|
日本不卡无码一区二区三区|
黄色片视频网站在线看|
香蕉在线凹凸分类视频|
亚洲av片无码久久尤物|
欧美亚洲国产一区在线观看99国产黄色視頻网站
|
一区二区国产高清不卡线视频|
午夜免费av在线|
亚洲AV综合A国产AV中文|
日韩av一级片在线播放|
97爱人妻免费公开视频|
a97se亚洲国产综合自在线|
亚洲美女午夜福利视频|
自拍欧美一区精品国产|
最新精品国产|
精品无码在线看片|
亚洲国产高清一区二区在线|
成年女人免费视频试看46|
欧美午夜A片缴情性影院竹菊影視
久久天天躁狠狠躁夜夜av不卡
|
色欲av无码午夜免费看|
免费三级亚洲人成|
久久丫不卡人妻内射中出|
久精品亚洲无中文国产91麻豆免费观看|
99精品国产综合在线|
av天堂亚洲国产av|
又爽又黄又无遮挡的照片美女|
午夜精品国产不卡|
成人永久免费视频网站app|
无码人妻精品中东京热|
亚洲欧美高清偷拍一区|
免费看又黄又无码的网黄网在线播放
|
亚韩中文字幕欧美|
四虎A片在线精品免费|
亚洲国产丝袜精品久久久一区二区|
亚洲av日韩aⅴ电影|
亚洲 成人 另类 校园 人妻|
惠民福利亚洲综合第一欧美日韩中文|
日韩美女喷水大片在线观看|
亚洲精品国产成人综合爱情岛|
国产黄色精品高潮播放|
国产重口另类极限扩张视频网站|
久久丫不卡人妻内射中出|
国产欧美美女精品自拍酒店午夜一区|
人人射人人澡|
热@无码热@国产热@综合|
国产精品无码电影院|
国产99视频精品免费视频6互動交流|
91久久精品国产性色也|
无码一区精品精油按摩|
午夜高h在线影院|
亚洲性日韩精品一区二区|
亚洲日韩精品高清在线|
8888国产精品视频|
日韩精品一区二区三区视频网|
日韩一级A片在线精品视频|
久久久精品动漫|
一区二区自拍视频|
国产一区二区精品久久久蜜臀|
亚洲av日韩av无码黑人|
午夜性开放A级视频|
囯产精品一区二区三区线亚洲AV无码精品色午夜蜜芽
|
av电影网站在线观看一区二区|
avtt免费播放一区二区三区|
国内女人自慰一区二区三区|
3d精品动漫在线一区二区三区|
伊人精品视频|
久久免费视频在线观看|
久久国产欧美国日产综合精品|
一区二区三区美女视频图片|
精品人妻中文码一区二区|
人妻精品久久久中|
中文字幕大香视频蕉无码按摩|
午夜福利无码免费体验区|
太紧太爽太黄太粗太大|
你是我的女人中文字幕高清|
国产加勒比无码视频在线|
亚洲中文字幕高清有码在线|
一区二区三区在线亚洲电影|
日韩精品在线观看视频|
一本久道综合久久精品|
日本高清不卡免费|
国产男女爽爽爽爽爽视频|
中文字幕精品亚洲一区不卡|
精选国产在线观看一区二区三区|
一级乱电影在线观看|
国内外成免费视频播放不卡
|
毛片色毛片18毛片美女|
亚洲自拍偷拍第一页|
国产理论精品一区二区|
丰满少妇被猛烈进入无码免费
|
激情另类欧美综合|
六月天丁香婷婷|
惠民福利国产裸拍裸体视频在线观看|
2020国产成人精品久久|
国产福利精品导航福利|
中文无码熟妇人妻av|
国产在线播放综合网房|
日韩av三级电影|
60后老熟妇乱子伦视频|
久久精品成人91一区二区孕妇|
日韩理论片午夜无码|
久久精品亚洲洲国产av|
三浦恵理子息与子中文字幕|
亚洲熟女精品不卡一区二区|
中文字幕中文字幕亚洲|
免费一级A毛片在线播放软件|
亚洲制服丝袜无码a∨在线|
久久久婷婷成人综合激情|
国产亚洲福利蜜臀|
亚洲AV无码AV吞精久久久|
成 人香蕉 在线手机版视频|
免费观看的成年网站不下载|
一个人www视频在线国产|
久久久亚洲国产视频|
欧美综合在线24p不卡|
欧美日韩精品亚洲一区二区三区|
能在线看的av网站|
午夜精品国产不卡|
久久完整一级a免费|
极品专区高清在线|
爽灬爽灬爽灬毛及a片|
国产gaysexchain男同men高清|
国产精品无码A v片在线观看播|
少妇高潮好爽在线播放|
国产一级爱做c免费视频|
亚洲精品在线观看麻豆|
免费高清无码在线观看|
日韩黄在线观看免费|
午夜免费av在线|
成人美女隐私免费|
日韩毛片在线影视|
欧美日韩视频在线视频精品|
欧美日韩女优在线视频|
成品禁用app漫画i|
欧美性爱视频人人看|
看毛片国产高清一区二区|
人妖系列在线精品|
伊人久久大香线蕉综合07|
国产午夜在线视频福利|
18免费视频无遮挡在线观看|
国产激情综合在线视频|
国产下药迷倒高中校花在线|
久久99看少妇高潮1|
国产精品午夜无码体验区麻豆|
麻豆传播媒体app大全免费版在线下载
|
国产极品尤物精品在线免费观看|
91尤物无码国产在线观看|
综合欧美三级中文|
欧美日韩国产激情在线视频|
星空传媒视频在线观看|
色婷婷aⅴ日韩一区二区三区|
国产目拍亚洲精品二区蜜芽|
日本三级视频一区二区久久|
日韓激情小視頻|
国产午夜三级一区二区三区|
免费又色又爽又黄的视频入口|
成人av电影网在线观看|
岛国国产在线观看网站|
欧美一级在线国产|
久久国产精品一区不卡福利伊人|
蜜桃视频高清在线观看|
国产精品成人精品一区二区|
一级毛片视频在线观看|
青草久久中文字幕|
国产美女精品网站在线看|
边做边爱完整版免费视频播放茄子|
亚洲中文字幕不卡一区二区三区|
国产成人无码区在线观看流畅
|
看高h猛烈失禁潮喷视频|
亚洲欧洲日产国码av系列|
成人一区二区三区四区五区六|
无码色妞久久久9噜噜噜噜噜噜噜噜|
97av视频在线播放|
亚洲熟妇精品一区二区在线播放|
久久精品国产91精品亚洲高清|
国产精品永久网址|
他的水蜜桃免费阅读全文小说|
亚洲永久精品日本无码|
中出无码一区二区三区无码|
3d精品动漫在线一区二区三区|
久久亚洲精品动漫无码av|
澳门无码片免费播放|
亚洲无碼网站观看|
欧美精品影院在线观看|
色黄国产午夜精品久久久久久|
荔枝成人免费视频观看|
色播五月综合网狠狠|
黄色片视频网站在线看|
国产亚洲av成人久久精品|
免费黄色av电影在线观看|
欧美专区91日韩专区|
男生女生一起差差差带疼痛的声音|
日本一区二区三区免费看片|
男人扒开女人下面添动态图|
1769视频国产在线手机版|
九色成人蝌蚪电影在线|
日韩免费无砖专区2020狼|
亚洲ⅴ国产ⅴ欧美ⅴ久久久久久|
靠比网站在线观看|
手机看片国产av无码首页|
欧美国产日韩在线一区|
在线观看无码流出国内|
天天干天天五月天婷婷|
超碰成人在线播放|
k频道国产网红欧美在线视频|
加勒比欧美激情欧美精品一区二区|
国产激情综合在线视频|
久久88香港三级|
亚洲国产日韩在线人成下载|
三浦恵理子息与子中文字幕|
亚洲?v成人精品二区|
一区二区三区亚洲免费|
亚洲AV无码一区二区三区欢看|
亚洲精品国偷拍自产|
国产午夜亚洲精品午夜鲁丝片|
996热久久r这里只有精品|
啪啪啪视频国产中文字幕|
亭亭玉立国色天AV|
卡一卡二卡三国产传媒|
国产a级三级三级三级中国|
免费视频在线观看一区|
99免费网站在线观|
国产亚洲欧美精品综合观看三区|
加勒比欧美激情欧美精品一区二区|
三级无码潮喷不卡在线观看|
久久国产AV无码专区亚洲欧洲精品一区二区三区不卡
|
人妻免费久久久久久久了|
一本久道综合久久精品|
国产精品美女久久久久Aⅴ超清|
亚洲毛片无码专区亚洲
|
五月激情综合网久久影院中文字幕|
国产女人毛片一区二区|
男人扎爽进女人j羞羞漫画|
日韩欧美不卡成人中文字幕|
免费人成无码视频在线不卡
|
麻豆国产97在线/欧美|
五月天婷婷性爱视频|
偷窥闺房高清影院在线观看|
国产日本韩国91|
久久99看少妇高潮1|
99久精品中文在线视频|
亚洲国产成人无码AV影院|
亚洲毛片无码专区亚洲|
东北老富婆高潮大叫对白视频|
黄色成人网站免费无码av|
日韩毛片免费av|
国产精品自拍亚洲|
麻豆亚洲āv永久无码精品久久|
色婷婷亚洲婷婷五月小说专区
|
亚洲天堂性AV在线|
青青草99热这里都是精品|
成年a级毛片免费播放|
精品国产午夜福利757|
日韩二区成人在线|
一个人看的在线观看视频|
孕妇奶水仑乱A级毛片在线播放|
特黄特色的国产三级精品|
午夜欧美激情视频|
日本50岁丰满熟妇xxxx|
在线亚洲欧美精品|
欧美肥胖老妇videos另类|
狠狠综合久久久久|
青青河边草在线观看免费视频|
手伸进她内裤里狂摸的漫画|
国产黄片的免费看|
国产精品无码久久av丝袜喷水|
国产手机?V片在线无码观你|
大胆日本一区二区三区在线播放|
午夜久久精品国产|
国产你懂的在线|
成人电影国产a毛片|
日韩av无码国产精品一区亚洲
|
91午夜精品一区二区|
澳门无码片免费播放|
日韩理论片午夜无码|
爱情岛网站亚洲禁18进入|
亚洲男人的天堂av在|
日韩一级A片在线精品视频|
人妻有码ΑV中文字幕久久琪琪布久久少妇视频|
欧洲人妻丰满aⅴ无码久久不卡了
国产亚洲欧美另类中文91
|
欧美日韩一区二区高|
99p?o在线视频国产|
日本在线视频你懂的|
国产综合五月婷婷|
亚洲精品无码国产一区二区|
欧美成人做性视频在线播放|
美女裸着动态黄视频|
国产二区精品福利|
在线视频精品午夜|
AⅤ人妻中文无码视频|
欧美色淫麻豆视频|
国产精品毛片?v一区二区三区|
少妇无套内射免费观看视频|
国产一级高清免费观看|
国产在线精品一级?片|
99久久无色码中文字幕人妻
|
精品国产激情在线|
茄子短视频看黄专用|
久久精品不卡中文字幕|
2018天天看夜夜操狠狠操|
一级乱妇欧美69堂|
麻豆av片在线播放|
一级毛片中文免费观看|
日韩欧美成人免费网站观看|
成人 国产 免费|
亚洲精品日韩欧美专区|
欧美狠狠入鲁一区二区三区|
丰满人妻a√无码|
国产精品92视频免费观看|
看毛片国产高清一区二区|
天天爽天天狠久久久综合|
亚洲三级片在线观看无码|
啪啪熟女免费视频|
ASS人体下部模特PICS|
怡红院首页色网视频|
欧美精品久久久天堂|
激情亚洲人妻视频|
免费无码又爽又刺激高潮视频男
|
国产精品92视频免费观看|
国色天香社区视频在线观看完整版|
青青国产视频|
91精品国产搜索一级毛片|
亚洲国产日韩欧美一区|
久久久久久一区二区三区四区|
AV每日资源中文字幕|
综合天堂va欧美ⅴa亚洲|
亚洲丝袜中文字幕|
欧美伦理一区二区三区电影|
國產自在自線午夜精品視頻在|
日本韩国一区二区免费|
精品久久久久九九九九国产潘金莲|
惠民福利69国产成人综合久久精品|
欧美激情婷婷|
一本日本在线视频免费播放|
欧美一区二区日韩在线观看|
亚洲欧美手机在线|
亚州国产精品女人视频久久久|
(愛妃)日韩少妇极品熟妇人妻潮喷|
日韩亚洲欧美久久|
色老头成人免费视频天天综合|
国产乱了真实在线观看|
日本高清中文在线|
国产精品麻豆AR影院|
中文字幕亚洲综合久久|
女人裸体扒开下身照片无遮挡|
色婷婷亚洲婷婷五月小说专区
|
亞洲а∨天堂久久精品ppypp|
国产精品黄a一级在线|
欧美黑人巨大巨粗性AAAA
|
亚洲无碼网站观看|
91午夜精品一区二区|
男女一级毛片免费|
中文字母AV一区二区三区|
毛片全部无码播放|
亚洲爆乳无码专区按摩无码专区
|
免费高清特级毛片a片微信群|
他的水蜜桃免费阅读全文小说
|
亚洲乱码中文高清|
人成视频在线观看免费国产|
国产自无码视频在线观看手机
|
四虎精品影院4hutv四虎
|
亚洲无碼网站观看|
美国一级毛片在线|
久久久噜噜噜久久69|
欧美18精品久久久无码毛片a片麻豆|
大香蕉久久综合精品|
欧美人成视频|
免费一级A毛片在线播放软件|
99久久国产综合精品网成人|
超碰在线观看caoprom超碰公开|
97超频国产在线公开免费视频|
国产女人在线亚洲成人播放|
欧美丁香缴情精品国产乱伦|
国产成人av专区|
成年女人免费视频试看46|
国产福利精品导航福利|
欧美 日韩 中文字幕 在线|
成人午夜亚洲精品无码网站|
成·人免费午夜性|
农村老熟妇乱伦子视频|
日韩理论片午夜无码|
无码久久精品国产亚洲?v影片|
免费看黄色a级大片|
欧美黄色免费网址|
se94se在线亚洲视频|
欧美精品久久天堂久久|
中文字幕专区精品一区二区|
噜噜噜日日日|
2020国产成人精品久久|
久热这里只有精品在线观看|
国产精品国产三级国产专播|
婷婷 丁香 五月天 人妻|
欧美精品国产日韩一区二区三区|
成年黄页网站视频大全|
日韩电影无码一区二区三区|
综合色区亚洲熟妇p|
成人国产亚洲国产AⅤ精品一区二区影视
|
欧美在线观看免费专区|
成人毛片一区二区三区a∨9毛片|
亚洲精品国产成人?v蜜臀|
精品人妻中文码一区二区|
97久久精品无码一区二区天|
永久免费国产一级A片|
不卡中文1区2区|
波多野结衣一区二区三区av高清|
女自慰喷水精品www久久久|
在线观看无码色网视频|
人妻无码系列一区精品|
99久久国产综合精品网成人|
又硬又粗又大又爽时间持久在线
|
国产日韩黄色大片|
日本美女18禁网站免费观看|
亚洲永久精品一二三区|
天天爱天天做久久狠狠做短片|
制服丝袜中文字幕久久一区|
日韩精品成人网页在线观看免费|
麻麻被同学在客厅cao到爽|
日韩熟女一级av|
欧美性做爰片免费观看甜与辣|
先锋影音男人资源站|
亚洲国产日韩欧美永久在线观看|
勾搭那些事资源在线观看|
最新国产一区二区在线|
精品福利热国内精品永久免费观看|
久久高清少妇三级|
国产V?免费精品高清在线观看
|
成人激情在线|
欧美亚洲综合激情在线|
在线中文高清资源免费观看
|
成人永久免费视频网站app|
精品国产v无码大片在|
上司丰满人妻一级A片
|
亚洲va欧美va国产va|
2020国自产精品高潮|
日韩黄片在线乐享潮不休!|
亚洲熟女妓女av一区二区三区
|
亚洲综合精品资源在线|
午夜福利影院一区二区三区|
欧美激情小说综合网|
中文幕无线码中文字夫妻|
国产日韩在线正在播放|
男人裸j照无遮挡男|
国产午夜草莓视频在线观看色香天天影视来吧综
|
亚训AV日韩专区在线|
久草综合欧美|
亚洲女人丰满毛多水多|
久久久特级无码AV二区免费看|
亚洲av日韩综合一区久热|
无码变态露出magnet|
国产欧美日韩精品电影在线观看|
欧美黑人又大又粗高潮喷水|
能够直接看的无码AV|
国产一区二区三区午夜精品久久|
三级片的网址在线免费观看|
成人在线一区二区网站|
欧美一级在线国产|
日韩免费a级毛片无码a∨|
亚洲三级片在线观看无码|
五级毛片亚洲欧洲综合网|
日韩一级A片在线精品视频|
激情文学国产AV|
人妇人妻无码专区在线视频|
成人亚洲无码观看日韩涩涩高清|
中文字幕有码免费一区二区|
欧美孕交视频|
欧美亚洲精品邻居|
欧美一级二级一区|
国产精品黄片一区二区三区免费|
免费的日本黄色视频|
久热这里只有精品在线观看|
国产V?免费精品高清在线观看|
AⅤ人妻中文无码视频|
国内精品日韩一区二区三区|
国产在线一区二区91|
国产成人av综合免费观看|
成人永久免费A∨一级在线播放|
麻花豆传媒MV在线观看软件|
亚洲色成人无码Av|
成人午夜福利在线免费观看|
国产手机?V片在线无码观你|
积积对积积的桶30分软件|
91无码欧精品亚洲日韩一区|
免费看黄色a级大片|
老师脱了内裤让我进去|
久久免费视频在线观看|
欧美69熟妇在线播放|
国产呦在线观看|
夜夜躁狠狠躁日日躁视频蜜月av|
野花社区www视频日本|
LSP破解软件库合集链接地址
|
性五月天天婷婷|
日韩欧美国产午夜在线|
亚洲国产综合久久灌醉|
国产女主播菲菲全部视频|
欧美性色生活片一级|
国产精品探花一区二区在线观看|
性五月天天婷婷|
国产精品激情欧美|
一起草17c资源在线观看|
人无码aⅴ片在线观看|
二次元人物做剧烈游戏|
国产最新视频网址|
国产精品午夜无码体验区麻豆|
久久精品国产亚洲av热亚洲性
|
日韩美女在线观看不卡一区|
日韩毛片在线影视|
少妇无套内射免费观看视频|
亚洲春色校园小说另类|
国产精品嫩草毛片视频|
饥渴少妇av无码毛片69|
日韩a级无码免费视|
欧美劲爆色情av播放|
超清无码无码二区无码三区|
精品国产乱码久久久久久软|
中国av毛片在线观看|
av在线不卡一二三区|
亚洲中文字幕最新2021芒果|
黄色免费影视|
性一交一乱一伧一小说有声|
2024精品国产品免费观看|
影音先锋熟女少妇av资源|
中文字幕东京热女人|
日韩欧美国产传媒|
差差差30分钟免费下载软件大全|
亚洲日本久久|
亚洲国产精品不卡在线播放|
国产加勒比无码视频在线
|
成人一区二区三区四区五区六|
大胆日本一区二区三区在线播放|
91一区欧美精品第三页|
亚洲美女午夜福利视频|
一个人看的在线观看视频|
野花社区www视频日本|
国产精品国产三级a√按摩|
日本视频网站在线www色|
欧美孕交视频|
蜜桃视频网站在线观看|
亚训AV日韩专区在线|
男生和女生一起错错错的轮滑鞋|
国产精品一区二区成人|
久久精品蜜芽国产亚洲av|
欧美日韩东京另类|
亚洲vα成无码人在线观看|
青青青在线观看播放免费|
国产精品麻豆AR影院|
日韩免费a级毛片无码a∨|
国产精品va无码一区二区在线观看
|
免费观看一区二区三区av|
2021国产丝袜在线观看|
国产成人无码在线视频|
一起草成人免费AV|
精品亚洲成?人片在线观看|
欧美一级二级一区|
91尤物无码国产在线观看|
成人永久免费A∨一级在线播放|
乱无伦码中文视频在线|
成人三级电影在线|
内地丰满浓密老熟女露脸对白|
自拍偷拍欧美专区|
无码人妻精品中东京热|
一本色道久久综合亚洲精品高|
色就色欧美综合在线影院|
成人毛片一区二区三区a∨9毛片|
avtt免费播放一区二区三区
|
亚洲vα成无码人在线观看|
欧美一级在线国产|
欧美激情小说综合网|
国产电影久久久精品|
激情都市综亚洲精品综合|
又粗又大又爽成h人视频|
av成人在线亚洲|
免费国产一级 片日本欧州|
中文成人精品久久一区|
亚洲欧美高清偷拍一区|
免费A级毛片无码无遮挡电影|
亚洲日韩中文字幕播放一区|
上司丰满人妻一级A片|
亚洲主播在线视频|
欧美狠狠入鲁一区二区三区|
91麻豆精品在线播放|
性猛交xxxxx按摩欧美|
久久精品人人88|
东京热av一区二区三区四区|
草莓视频WWW在线观看|
人妻中文经典无码|
欧美一区二区三区黄色片|
好爽好刺激的视频在线观看|
手机免费看国产黄色片|
亚洲欧美视屏|
在线观看日韩亚洲|
又粗又黄又硬又爽免费视频|
老欧性老太色HD大全|
男女肉粗暴式进入120秒|
日韩a片免费无码完整版电影|
国产一区二区三区无码视频|
激情a片久久久久久app下载|
欧美国产日韩va另类|
极品少妇第一次偷高潮哇哇大|
免费看干一级黄色|
AAAA久久精品国产精品亚|
强制高潮18XXXX按摩它|
欧美大片无尺码在线观看|
十八禁亚洲黄污啪啪网站|
99RE6热视频这里只精品首页|
亚洲国产午国产精品福利一区二区|
欧洲午夜精品|
精品免费视频中文字幕2020|
日本1级a爱做费免不卡片|
综合无码精品色图|
91香蕉视频下载污|
亚洲91无码精品一区在线播放|
亚洲精品园精品久久99热|
国产二区日韩在线|
久久久无码精品亚洲日韩日韩αv
Wwwav日韩色网毛片com
|
国内自拍日韩在线观看|
啪啪熟女免费视频|
久爱www免费人成福利播放|
国产精品六区九九综合亚洲
|
男女啪啦啦超猛烈动态图
|
免费的成人一级毛片|
亚洲一级大黄大色毛片www|
国产精品久久婷婷婷婷
|
国产高清精品国语特黄A片|
好男人资源在线观看播放视频网|
欧洲最强RAPPER潮水喷|
日韩精品另类无码免费观看|
国产成人无码一区二区动漫|
美女高潮视频无遮挡|
国产精品永久网址|
欧美国产日韩一级在线|
正在播放国产国语在线精彩视频|
精品国产一区二区三区网站|
久久国产AV无码专区亚洲欧洲精品一区二区三区不卡
|
狼人香蕉国产在线视频|
国产精品成人精品一区二区|
日韩欧美国产传媒|
呦系列视频一区二区三区软件|
女人久久香蕉精品网站影视|
欧日韩亚州欧洲无码|
上海外企女3p黑人老外|
熟女视频综合免费|
91国语精品自产拍在线观看|
97乱码在线观看專業從事互動平臺
|
日韩综合免费一区二区三区四区|
国产黄色精品高潮播放|
亚洲精品国产A综合第一|
日韩免费在线观看国产一区二区三区|
亚洲天堂2024无码|
91久久精品国产性色也|
国产精品性爱亚洲黄片大全|
草莓视频污黄APP|
日本一区二区三区免费看片|
1区2区3区高清视频|
国内性爱精品亚洲|
小草影院在线观看视频播放|
精品偷拍日韩第一页|
日韩无码电影中文二区|
亚洲AV无码一区二区三区欢看|
91久久久久久亚洲精品|
无线国产资源第1页|
91短视频APP在线观看|
黑人巨大一区二区三区|
亚洲国产精品真实内射|
日韩电影无码一区二区三区
|
玩弄少妇肉体到了高潮|
日韩黄色一级电影|
国产精品六区九九综合亚洲|
性一交一乱一伧一小说有声|
3d精品动漫在线一区二区三区|
综合久久性色av|
18免费视频无遮挡在线观看|
欧美精品一级视频在线观看|
亚洲精品国产导航一区二区|
一区二区三区免费观看视频|
亚洲影视精品中文|
国内精品国内自产视频|
成人毛片一区二区三区a∨9毛片|
a天堂中文最新版在线官网|
真人一级一级97一片a毛片|
国产成人精品午夜视频''
|
午夜性无码视频无码|
无码熟妇αⅴ人妻又粗又大
|
国产主播一级毛片|
自拍偷自拍亞洲精品偷一|
在线欧美亚洲国产一区二区三区|
2022亚洲国产精品福利无码|
日本一区二区三区免费看片|
亚洲91无码精品一区在线播放|
国产二区日韩在线|
老熟女人亚洲av|
午夜福利影院一区二区三区|
亞洲視頻三區|
涩涩激情免费视频在线|
久久九九日本韩国精品|
国产女主播菲菲全部视频|
日韩欧美不卡成人中文字幕|
精品视频免费日产一区|
成人国产亚洲国产AⅤ精品一区二区影视
|
少妇亚洲综合高清|
国产夫妻视频一区|
日本视频在线观看免费|
成人免费在线黄色|
在线观看无码免费视频网址|
国产成人年无码片在线观看
|
8日韩一级一片内射视9一|
人妻丰满熟妇av无码老和小|
女人久久香蕉精品网站影视|
欧美日免费不卡视频|
韩国自拍视频大全精品|
呦系列视频一区二区三区|
日韩无码导航网页|
日本国产欧美精品久久久|
在线视频精品午夜|
欧美一区二区三区不卡在线|
国产波霸爆乳一区二区精品|
一级毛片在线免费观看视频|
色狠色婷婷丁香五月|
尤物在线点击一区|
99re最新精品国产|
在线观看国产丝袜一区二区三区|
女自慰喷水精品www久久久|
亚洲中文字幕国产视频|
大地影院神马高清完整在线观看|
免费观看一级电影在线|
亭亭玉立国色天AV|
视频一区二区欧美激情|
免费无码va一区二区三|
免费观看一区二区三区av|
538高清无码在线网站|
国产美女精品自在线拍电影|
韩国一级片免费|
亚洲国产成人一区二区网站|
国产在线一区二区91|
性一交一乱一伧一小说有声|
日韩在线第一页播放|
国产欧美日韩黄片|
亚洲中文字幕1235|
台湾三级—中文字幕|
成人免费观看三级毛片|
国产激情综合在线视频|
欧美亚洲精品综合网|
久久激情无遮挡免费视频|
任你操在线视频免费观看|
日本美女18禁网站免费观看|
国产女主播菲菲全部视频|
中文字幕系列每日更新一区|
a毛片视频免费观看|
毛片黄片一级免费看|
女人久久香蕉精品网站影视|
国产另类重口视频|
亚韩中文字幕欧美|
深夜免费a级毛片久久|
欧美专区日韩高清|
亚洲AV综合色区无码专区蜜桃|
欧美国产日韩午夜|
黑毛毛一区二区|
亚州精品无码a片毛片妍美乳|
成视频年人免费看黄网站|
欧美专区日韩高清|
国产又猛又粗又爽的视频|
亚洲综合欧美综合久久麻豆
|
亚洲欧美国产成人久久|
99国产精品尤物免费视频|
五级毛片亚洲欧洲综合网|
青青青草原亚洲综合|
性猛交xxxxx按摩欧美|
精品亚洲视频99|
亚洲欧美制服三级另类|
中文字母AV一区二区三区|
久久蜜桃亚洲一区二区|
一女n男巨h高辣h文np|
亚洲国家精品欧美久久
|
在线中文高清资源免费观看|
日韩精品亚洲首页|
欧美成人午夜激情在线观看|
中文字字幕人妻|
亚洲图片日韩专区|
色综合久久天国91精品|
日韩高清wwww午夜色com|
久久亚洲?V成人无码国产|
亚洲午夜视频体内射|
亚洲国产aV无码AV一区|
亚洲精品国偷拍自产|
日韩毛片免费av|
成人淫片视频99|
午夜网站小视频|
亚洲影视精品中文|
三级在线观看专区国产|
国产福利精品导航福利|
中文字幕a∨电影在线观看|
都市激情 在线 亚洲 国产|
av无码免费高潮喷水不卡
|
欧美69熟妇在线播放|
亚洲av成人免费看|
欧美破苞系列二十三铁牛影视|
国产成人无码小说在线观看|
欧美激情五月天在线|
国内自拍网站在线播放|
麻豆视频网站|
爽灬爽灬爽灬毛及a片|
免费三级亚洲人成|
国产男女爽爽爽爽爽视频|
538prom国产一区二区三区|
国产精品探花一区二区在线观看|
漂亮人妻被强中出中文字幕|
女人爽爽爽的免费视频全部|
澳门无码片免费播放
|
青青河边草在线观看免费视频|
国产精品a一区二区三|
亚洲一道av无码午夜福利
|
啪啪的时候感觉顶到了里面疼|
久久成人亚洲国产|
污视频免费久久免费|
国产日韩av免费在线观看国产成人av精品777777
|
亚洲水蜜桃av网站|
高潮喷吹精品无码视频一区|
又粗又硬又爽国产毛片|
免费看黄色a级大片|
久久一级视频电影|
久久国产AV无码专区亚洲欧洲精品一区二区三区不卡
|
日韩特级无码av中文字幕|
一本久道综合久久精品|
8888国产精品视频|
在免费jizzjizz在线视频|
成人精品一区二区三区中文|
亚洲毛片一区二区无卡午|
国产精品无码A v片在线观看播|
激情亚洲成人小说激情|
精品午夜无码人妻一区二区|
欧美国产图片视频小说|
无码变态露出magnet|
亚洲欧美自拍另类日韩|
国语自产免费精品视频在|
久久亚洲A∨成人无码国产电影|
日批视频网址免费观看
|
国产自无码视频在线观看手机
|
成人美女隐私免费|
成视频年人免费看黄网站|
在线一区二区国产|
亚洲精品人成网在线播放蜜芽|
日本不卡无码一区二区三区|
啦啦啦中文在线视频免费观看|
影音先锋无码资源男人网|
人无码aⅴ片在线观看|
精品欧美日韩国产一区|
超清制服丝袜无码αv福利网|
日本精品第一色网在线|
好硬好涨老师受不了了在线阅读|
青青青欧美在线视频免费|
免费一级A毛片在线播放软件|
无码人妻厨房色诱中文字幕|
国内精品自在自线视频在线观看|
中日韩V?无码中文字幕|
久久九九机热国产精品|
91丨精品丨蝌蚪丨白丝jk|
办公室丰满秘书bd正在播放|
国产精品九九九久久久|
国内女人自慰一区二区三区|
天堂精品一级毛片A久久久久|
99久久无色码中文字幕免费
|
ā亚洲Vā欧美vā国产综合|
一级一级97片看一级毛片|
香肠想进扇贝网站app大全|
么公午夜在线播放视频|
给丰满丁字裤少妇按摩到高朝|
免费啪视频一区二区三区|
亚洲日韩欧美一区久久久我|
奶头好大揉着好爽视频|
欧美一级黄色18片免费看|
亚洲永久精品www47|
欧亚乱色一区二区三区|
国内视频精品极品在线播放|
久久伊人激情综合网|
国产精品色呦呦呦|
999视频在线观看|
九一视频国产欧美日韩|
久久99免费国产精品|
久久伊人激情综合网|
欧美一级A片视频免费播放久久|
手机中文字幕在线视频|
国产深夜福利免费|
亚洲国产日韩欧美永久在线观看|
综合久久性色av|
人成视频在线观看免费国产|
国产精品麻豆AR影院|
a毛片视频免费观看|
开心色怡人综合网站|
538prom国产一区二区三区
|
狼友视频网站免费网址|
亚洲热妇无码Av在线热播|
8888国产精品视频|
日韩精品欧美视频在线观看
|
亚洲无码重口味在线|
亚洲中文字幕国产视频|
乱伦+免费+网站+视频|
AV天堂 热の中文 热の偷拍|
高清欧美亚洲国产日本下载|
午夜福利真人一级毛片|
欧美放荡寡妇在线视频|
波多野结衣办公室在线观看|
五月天国产在线无码视频|
日韩电影无码一区二区三区
|
国产一道精品一区二区三区|
国产精品真实对白精彩久久|
久久久久中文无码精品|
日韩在线视频亚洲国产一区二区三区|
三级精品久久久久久久|
在线视频一区二区不卡|
欧美一级片在线观看国产一级黄片|
毛片网站大全在线免费观看|
国产极品尤物精品在线免费观看|
九色成人蝌蚪电影在线|
国产精品日韩免费观看|
午夜性无码视频无码|
欧美在线一区观看免费|
久久久久久久久久久久久久
|
国产成人无码小说在线观看|
动漫精品无码精品一区二区|
日本美女18禁网站免费观看|
亚洲精品高清一二区久久|
午夜免费av在线|
国产凸凹视频一区二区|
亚洲国产午国产精品福利一区二区
|
国产各种高潮合集在线|
久久国产欧美一区二区三区|
国产高清VA婷婷|
又粗又硬又爽国产毛片|
欧美黑人又大又粗高潮喷水|
乱码精品一区二区三区|
午夜男女免费视频|
亚洲日韩精品高清在线|
国产精品午夜视频免费|
国产亚洲综合国产偷视频|
成人永久免费A∨一级在线播放|
欧美视频日韩电影|
免费人成激情视频|
四虎精品影院4hutv四虎
|
自拍欧美一区精品国产|
国产一区二区三区大尺度在线观看
|
在线黄无码视频观看|
岛国一区二区三区在线播放|
亚洲女人丰满毛多水多|
jizz在线观看免费高清|
在线观看免费黄色不卡网站|
亚洲日本欧美在线中文字幕|
无码人妻一区2区三区免费|
亚洲毛片无码专区亚洲|
免费观看国产女人高潮视频在线高清|
国内自拍日韩在线观看|
无码一级午夜福利|
国产精品丝袜美腿久久|
农村中国幻女4一6特级毛片|
久久免费黄片a级|
一区二区三区亚洲免费|
久久99精品成人免费毛片|
911精品在线观看|
老鸭窝一级毛片成人网站|
欧美日在线观看视频|
97影院超级碰碰夫妻收看|
11一12周岁毛片免费|
性爱少妇一区|
久久狠狠亚洲综合|
美国一级毛片在线|
日本高清不卡免费|
男女一级毛片免费|
又黄又湿免费视频|
国产高潮美女|
97乱码在线观看專業從事互動平臺|
无码精品一区二区无码|
国产一成人综合久久免费|
睡眠性格指导1∽6集|
在线一区二区国产|
手机看片一区二区|
老师脱了内裤让我进去|
在线亚洲欧美日韩精品|
亚欧乱色国产精品4视频|
日韩在线观看视频网站一区二区不卡|
在线观看亚洲精品无码|
亚瑟精品久久久久久|
亚洲精品国产911在线观看|
无码天堂人妻一区二区三区|
久久婷婷五月国产精选|
给丰满丁字裤少妇按摩到高朝|
亚洲精品在线网站|
亚洲精品无码国产一区二区|
草草色网视频在线观看|
精品999在线免费观看|
中文字幕亚洲无线码在线视频|
国产成人特级a级毛片试看|
激情熟女一区二区|
日本美女18禁网站免费观看|
国产成人精品高潮综合久久|
日本在线播放第二区|
久久伊人激情综合网|
亚洲成a人片在线观看国产不卡|
精品亚洲成?人片在线观看|
国产欧美日韩黄片|
日韩电影无码一区二区三区
|
9热在线视频精品网|
國產精品無碼AV私拍|
一区二区美女操比|
中文字幕专区精品一区二区|
gogo全球专业高清摄影|
欧美日韩精品中文字幕一区三区|
精产久久久国品一二三|
2021国产在线拍揄自揄视频|
日韩免费无码不卡夜夜爽|
99久久国产综合精品网成人|
秋霞一区二区|
日韩黄在线观看免费|
欧美激情婷婷|
亚洲三级片在线观看无码|
網友分享91狠狠操心得|
一本色道无码不卡在线观看|
中文字幕a∨电影在线观看|
狠狠色狠狠干|
色戒2小时38分在线观看|
国产欧美美女精品自拍酒店午夜一区|
av欧美av日韩av亚洲av国产|
草b视频在线免费观看|
内地高清无码手机视频|
亚洲无码午夜福利精品视频
|
日韩国产综合制服无码|
成人国产亚洲国产AⅤ精品一区二区影视|
女人被狂躁c到高潮喷水一区二区
丰满人妻被义子侵犯中文字幕
|
人爱爱免费视频|
产精品一区二区三区四区五区蜜桃|
男人天堂亚洲第一|
中文字幕無碼精品亞洲資源網久久
|
上司丰满人妻一级A片|
国产色网三级片在线观看|
欧美另类卡通亚洲|
免费看欧美日韩综合国产成人一区二区三区|
日日噜噜夜夜爽爽狠狠视频
|
国产成人av综合免费观看|
麻麻被同学在客厅cao到爽|
国产美女a做受大片观看|
国产av黄色网址|
日韩无码导航网页|
91精品国产在拍自线|
成人性三级在线视频|
午夜情深深bd视频播放|
美女啪啪啪高潮视频|
靠比网站在线观看|
国产成人精品综合久久久久小说|
11一12周岁毛片免费|
亚洲aⅤ成人一区二区三区天堂
|
国产在线播放综合网房|
蜜桃无码成人一区在线视频|
日本特黃的免費大片視頻|
亚洲毛片无码专区亚洲
|
久久88香港三级|
国产一级a作爱片全过程片52|
欧美日在线观看视频|
国产色婷婷精品综合在线手机播放|
1024香蕉频在线观看|
久久精品国产rmvb下载|
久久99精品久久久久婷婷暖|
激情文学国产AV|
草草色网视频在线观看|
人人精品视频在线观看|
午夜在线观看网站|
综合一区二区国产欧美亚洲|
久久久久中文无码精品|
18免费视频无遮挡在线观看|
亚洲中文字幕宗合网|
日韩欧美亚洲一区SWAG|
国产亚洲免费网站看日韩v片在线|
亚洲舒服久久精品动漫321|
97超频国产在线公开免费视频|
日韩不卡av在线播放探花|
99久久精品无码一区二区麻豆|
大胆少妇久久无码|
久久久噜噜噜久久69|
国产又色又爽又黄刺激的网站视频|
免费人妻无码中文系列精品|
日韩免费福利视频|
亚洲美女在线国产|
日韩尤物视频在线观看|
四虎精品影院4hutv四虎|
精品无码一区二区免费毛片|
日本免费最新高清不卡视频|
国产二区日韩在线|
丁香五月思思热|
性欧美暴力猛交bd|
国内真实刺激对白自拍视频|
人妻无码在线手机视频|
韩国一级片免费|
中文字幕视频三区在线观看|
午夜福利欧美日韩|
亚洲色大成人网无码|
午夜无码国产视频|
天堂资源最新版在线中文|
激情唯美欧美亚洲另类|
夜夜躁狠狠躁日日躁视频蜜月av|
99re热视频这里只精品|
日本一区二区三区中文字幕久久9999久久免费精品国产
|
在线免费看黄国产|
中文字幕三区|
日韩欧美国产中字|
国产亚洲综合国产偷视频
|
色l频道在线观看|
日韩不卡高清无|
国产V?免费精品高清在线观看|
久久夜夜亚洲一区|
奇米色777一区二区三区|
国产一区无码中文字幕在线观看|
欧美激情免费观看网站|
亚洲欧洲日产国码Aⅴ系列天堂|
欧美18精品久久久无码毛片a片麻豆
|
红桃高清在线播放免费观|
日本五十路视频|
五月国产婷婷在线观看|
欧美一级在线国产|
香蕉久久久成人国产精品|
av在线不卡一二三区|
曰本a级毛片无卡免费|
国产精品日韩免费观看|
一级黄色AV录像|
日韩亚洲综合精品国产|
國產精品自拍偷拍視頻|
国产成人午夜一区二区三区|
国产片欧美片亚洲片久久久综合|
极品少妇第一次偷高潮哇哇大|
好吊色成人在线视频|
国产高清精品国语特黄A片|
国产美女啪啪午夜福利免费|
久久亚洲精品动漫无码av|
国产你懂的在线|
国产一区亚洲二区三区|
中文字幕日本人伦无码|
伊人久久大香线蕉综合07|
亚洲成a人片在线观看无码|
久久这里只有国产精品|
国产精品亚洲一级AV第二区|
加勒比精品综合在线|
农村中国幻女4一6特级毛片|
成人色欲久久久|
欧美一区亚洲成人|
在免费jizzjizz在线视频|
欧美亚洲综合激情在线|
在线欧美日韩免费观看|
国产日韩视频在线观看网址|
超碰在线观看网址|
日韩精品高清不卡一区二区|
六月天丁香婷婷|
麻豆传播媒体app大全免费版在线下载
|
荔枝成人免费视频观看|
国产成人无码小说在线观看|
亚洲欧美国产日韩中文字幕|
亚洲欧美高清偷拍一区|
福利一区在线视频播放|
欧美成人免费全部观看60岁|
一本色道无码不卡在线观看|
色综合久久天国91精品
|
波多野结衣办公室在线观看|
成人毛片一区二区三区a∨9毛片|
三个黑人和一个亚洲女人|
国产又粗又硬又大爽|
老鸭窝一级毛片成人网站|
二人世界拔萝卜怎么玩|
亚洲乱码中文字幕手机在线|
精品午夜精品一区二区三区|
乱无伦码中文视频在线|
中文字幕黄色三级片|
1769视频国产在线手机版|
亚洲精品a区在线|
午夜无码国产视频|
国产精品白浆流出在线观看|
尤物在线点击一区|
亚洲精品人成网在线播放蜜芽|
国产精品国产三级国产专播|
寡妇张开腿让黑人捅爽|
产精品一区二区三区四区五区蜜桃|
国产成人av专区|
日本美女18禁网站免费观看|
亚洲精品国产导航一区二区
|
在线观看有码无码精品|
精品国产美女福利|
囯产精品一区二区三区线亚洲AV无码精品色午夜蜜芽
|
2022亚洲国产精品福利无码|
亚洲国产欧美高清在线|
亚洲āⅴ无码国精品中文字慕
|
天天躁日日躁狠狠躁AV中文
|
美女被日到高潮喷水在线观看|
日本少妇BBw撒尿视频|
3344在线观看无码不卡|
最新无码人妻在线视频|
jizz在线观看免费高清|
国产精品白浆流出在线观看|
三级a午夜电影|
欧美成人高清在线视频大全|
亚洲图片在线|
国产白丝老师教室呻吟视频|
亚洲 成人 另类 校园 人妻|
久爱www免费人成福利播放|
国产在线视频无遮挡|
国产99视频精品免视看9|
欧美精品一级视频在线观看|
亚瑟精品久久久久久|
午夜性无码视频无码|
免费v片在线播放|
亚洲一区二区三区av免费|
看真人视频A级毛片|
日本50岁丰满熟妇xxxx|
亚洲精品无码九九九九九|
一本一本久久a久久综合|
推荐国产福利一区二区三区在线视频|
欧美一流高清黄片免费看|
久久亚洲精品国产午夜福利|
国产小伙嫖妓在线播放|
成年拍拍拍免费视频网站|
中文字幕无码138页|
日本50岁丰满熟妇xxxx|
国产精品久久久久久精电影|
日韩亚av中文字幕在线观看|
成人免费观看三级毛片|
免费a级毛片高清在线网站|
成人一区二区三区四区五区六|
青青青欧美在线视频免费|
三级一区磁力freemovie情涩网|
国产亚洲欧洲在线成人|
国产强d在线播放免费|
一本九中文字幕在线播放
|
亚洲中文字幕1235|
成人美女隐私免费|
捆绑调教性奴老师美女视频|
国产在线不卡视频免费视频|
亚洲第一精品精品无|
粉嫩AV在线免费观看|
国产经典孕交在线视频|
未满十八免费在线中文字幕|
男女亲吻无遮挡免费网站|
麻豆亚洲āv永久无码精品久久|
日本高清中文在线|
九色成人蝌蚪电影在线|
中文字幕系列每日更新一区|
五月激情综合网久久影院中文字幕|
亚洲av无删减在线观看|
在线观看无码免费视频网址|
亚洲欧美双飞AⅤ天堂|
97色色亚洲日韩色|
国产一区二区三区在线观看影院|
日本午夜福利精品|
久久精品一区二区三区不卡中文|
男人扎爽进女人j羞羞漫画|
欧美日韩中文字幕在在线视频|
日本国产欧美精品久久久|
欧美一级A做免费观看|
荫蒂添到高潮视频免费观看|
久久亚洲?V成人无码国产|
中文无码熟妇人妻av|
欧美激情小说综合网|
青草青青产国视频在线|
产精品一区二区三区四区五区蜜桃|
无码精品一区二区无码|
扑克视频软件免费又叫又疼链接|
无码三级二区|
免费曰b爽爽爽爽看|
亚洲成AV人综合在线观看
|
特黄做受又大又粗又长大片|
中文男女做性无遮挡免费视频|
日韩电影天堂亚洲|
国产精品亚洲日本在线观看|
国产精品视频中文字幕91|
俄罗斯极品xxxx|
se94se在线亚洲视频|
最新无码人妻在线视频|
超清无码无码二区无码三区|
影院亚洲国产成人精品久久久|
国精品无码一区二区三区在线蜜臀
|
亚洲性夜夜综合久久麻豆
|
一级无码电影|
午夜免费啪视频观看网站|
日本久久精品免费一区|
久久亚洲A∨成人无码国产电影|
在线日韩成人电视免费观看视频|
中文天堂中文字幕|
一本色道无码不卡在线观看|
惠民福利亚洲综合第一欧美日韩中文
|
久久精品蜜芽国产亚洲av|
波多野结衣一区视频在线|
黄片免费在线播放|
国产亚洲欧美精品综合观看三区|
亞洲歐美精品絲襪一區二區|
国产美女啪啪午夜福利免费|
日本人妻熟妇一区二区aPP|
青青国产成人AV片免费|
久久精品成人91一区二区孕妇|
免费v片在线播放|
久久精品成人91一区二区孕妇|
精品人妻人妻人一区二区有限公司|
日韩av三级电影|
亚洲女人丰满毛多水多|
亚洲aⅤ中文字幕|
國產在線精品成人一區二區三區'|
亚训AV日韩专区在线|
97精品国产高清久久久久蜜芽|
国产日本在线观看播放|
人人射人人澡|
亚洲综合欧美综合久久麻豆|
啪啪熟女免费视频|
国产精品视频流白浆免费视频|
五月婷av综合网色伊人苍井空|
亚洲日韩一区二区一无码|
日本一区二区三区经典视频|
最新国产亚洲精品中文在线|
男女无套免费网站国产|
亚洲无码在线精品免费|
好色先生软件免费下载|
亚洲人与动人物a级毛片一|
激情亚洲成人小说激情|
黄页网站推广app软件下载|
97久久精品无码一区二区天|
日韩免费欧美一级片|
在线日本视频一区二区|
又爽又黄又无遮挡的照片美女|
91精品国产搜索一级毛片|
亚洲a∨日韩av高清在线观看|
国产自产21区丝袜|
国产日本韩国91|
开心色怡人综合网站|
最新精品国产|
最新福利视频午夜|
亚洲日韩欧美综合久久精品|
国产一级特黄无码视频在线|
久久久久中文无码精品|
国产爆乳无码av一区二区|
8x8x影库永久免费|
从后面艹大屁股啊啊啊好舒服.
|
无码专区在线97|
蜜桃aⅴ一区二区三区|
高清windows免费版|
91国内精品免费在线观看|
日本三级在线线观看网站|
久久久精品日韩欧美|
插菊花综合网1|
午夜福利利国产精品|
亚洲免费无码|
欧美日韩国产色综合|
午夜色色手机看片|
午夜精品国产不卡|
欧美国产影院|
日本久久午夜国产精品www|
性感少妇被插不卡一区二区|
蜜桃av视频一区二区|
女人爽爽爽的免费视频全部|
无码一区精品精油按摩|
劲爆欧美 亚洲 一 区三区|
亚洲国产欧美日韩综合专区|
麻豆久久精品国产剧情|
外国亚洲三级在线|
涩涩激情免费视频在线|
97久久精品无码一区二区天|
亚洲老熟妇老熟女1|
久久精品国产91精品亚洲高清|
哪些国产人妖有视频网站
|
中文字幕专区精品一区二区|
精品一区二区三区无码视频99|
微拍国产在线观看|
亚洲av免费成人生活电影|
国产一区二区三区啊啊|
亚洲AV无码精品网站色欲AV|
国产一国产一级毛片视频|
亚洲国产日韩在线人成下载|
免费高清自慰出水一区二区三区|
好男人资源在线观看播放视频网|
老司机精品无码中文字幕
|
激情a片久久久久久app下载|
极品专区高清在线|
欧美韩日视频精品中文在线|
国产三级日产三级国产av多人|
欧美图片电影天堂|
国产成人免费午夜在线观看|
视频黄页在线观看|
久久久久人妻无码视频|
欧美精品国产日韩一区二区三区
|
男人边吃奶边揉好爽免费视频|
深夜国产一区二区三区在线看|
日本五十路视频|
日本无码久久在线观看|
精品少妇专区偷人|
丰满人妻a√无码|
蜜臀成人片免费视频在线观看|
亚洲激情一级黄片|
亚洲特黄特色网站|
宅男视频网站在线观看|
欧美v亚洲v日韩最新在线播放|
手机在线观看的国产网站|
国产a刺激v视频刺激|
国产婷婷久久午夜|
稚嫩漂亮的大学生酒店在线|
亚洲日本欧美在线中文字幕|
欧美丰满熟妇久久久96喷水|
五级毛片亚洲欧洲综合网|
一区二区三区亚洲免费|
国产野战无套av毛片|
午夜性无码视频无码|
亚洲精品无码免费观看
|
日本成熟老熟妇XXXXⅩ|
精品国产成人一区二区|
久久久特级无码AV二区免费看|
一级中文在线播放|
国产精品久免费的黄网站|
1024日本有码合集|
国产三级热播电影福利|
欧美精品一区二区三区视频。|
精品福利热国内精品永久免费观看
|
五月天婷亚洲天综合网|
亚洲综合校园春色|
丁香花视频资源在线观看免费|
青青青vip国产精品|
97精品国产高清久久久久蜜芽|
全国三级网站免费观看|
囯产目拍亚洲精品小草|
饥渴老熟妇女乱人伦视频|
美女午夜激情免费福利视频|
国自产偷精品不卡在线|
欧美资源在线一区二区三区|
人妻暴雨中被强制侵犯|
男人的天堂久久精品激情a|
A久久精品国产精品|
国产美女极度色诱免费网站|
亚洲国产午夜精品理论片妓女|
婷婷国产综合精品|
久久99国产精品成人|
亚洲欧美经典国产|
yellow字幕网在线zmzz91|
亚洲高清无码不卡一区免费在线|
男人扎爽进女人j网站免费|
免费的三级片中文字幕无码
|
国产精品探花一区二区在线观看|
国内偷拍亚洲欧洲2018|
国产黄色精品高潮播放|
午夜男女免费视频|
亚洲av无码变态重口另类专区|
欧美性爱 在线 免费 观看|
一本色道久久东京热|
jizz在线观看免费高清|
奇米色777一区二区三区|
LSP破解软件库合集链接地址|
色亚洲中文字幕在线观看|
欧美国产日韩一级在线|
国内精品自产拍在线播放等最新內容|
色l频道在线观看|
日韩中出无码视频|
亚洲国产欧美高清在线|
寡妇张开腿让黑人捅爽|
中国毛片视频天天色成人|
日本三级在线线观看网站|
欧美国产日韩在线一区|
激情小说五月天在线视频丁香
|
日韩欧美在线成人|
国产成人av综合免费观看|
扑克牌又痛又叫免费下|
亚洲毛片播放视频|
国产三级在线线看免费|
又爽 又黄 免费视频|
蜜芽五月丁香综合啪啪|
女生和男生一起怼怼怼的游戏|
三更2饺子在地上做|
国产精品色午夜视频免费看|
女人被狂躁c到高潮喷水一区二区|
欧美一区二区三区免费在线观看|
久久综合综合久久97色|
三级伦理电影免费观看在线|
欧美日韩视频在线视频精品|
俄罗斯极品xxxx|
国产手机?V片在线无码观你|
少妇美女久久久久久|
动漫精品无码精品一区二区|
中文字幕无码av黄片|
日韩在线视频亚洲国产一区二区三区|
国产成人精品一二三区|
亚洲日韩精品高清在线|
成熟日本语热亚洲人|
国产精选一级毛片国语|
亚洲中文字幕5g在线|
婷婷丁香欧美在线综合一区|
裸体久久女人亚洲精品|
欧洲一区二区三区
|
久久免费视频插出白浆|
香蕉热线精品视频在线|
欧美另类亚洲视频二区|
孕妇奶水仑乱A级毛片在线播放
|
国产一区二区三区啊啊|
亚洲欧洲日产国码Aⅴ系列天堂|
国产一区二区在线观看免费视频|
亚洲欧洲日产国码Aⅴ系列天堂|
在线观看污片|
在线免费看黄片视频|
av在线不卡一二三区|
新play精品视频免费观看|
亚洲啪啪一区二区综合精品区|
欧美亚洲国产日韩不卡|
成人激情在线|
亚洲国产午国产精品福利一区二区
|
影音先锋无码资源男人网|
手机看片一区二区|
狠狠綜合久久久綜合|
一本不卡视频在线观看|
国产成人a亚洲综合无码|
欧美成人H版中文字幕|
亚韩中文字幕欧美|
一本久道综合久久精品|
视频黄页在线观看|
苍井空视频一区二区三区|
欧美人与动性xxxxx杂交|
在线观看肉片A免费不卡
|
日韩中文字幕在线专区|
av天堂亚洲国产av|
日韩美女日日操天天爽|
激情都市综亚洲精品综合|
亚洲精品高清一二区久久|
久久99免费国产精品|
又粗又黄又硬又爽免费视频|
免费看又黄又无码的网黄网在线播放|
日韩电影无码一区二区三区|
国产亚洲精品a在线看|
国产免费无码爽刺激|
乱无伦码中文视频在线|
麻豆av片在线播放|
久久丫不卡人妻内射中出|
国产精品99国产精品99|
色女Av免费在线|
亚洲人与动人物a级毛片一|
国产熟女视频网二区|
国产亚洲A v片天天在线观看
|
无码久久免费亚洲|
无线国产资源第1页|
无码变态露出magnet|
精品人妻中文字幕无码色欲|
国产av不卡网站|
自拍影视综合欧美|
欧美国产日韩在线一区|
在线观看亚洲精品无码|
欧美人与动牲a欧美精品|
国产在线播放人午夜|
男人扎爽进女人j羞羞漫画|
色香一区二区视频|
成人av免费在线看|
亚洲人成桃花岛久久久久久|
军人粗大的内捧猛烈进出视频|
欧美老妇多毛精品一区二区沤|
午夜剧场日韩精品一区|
激情综合亚洲欧美日韩|
国产一区二区三区淫秽电影|
少妇偷拍私密SPA按摩|
2020国自产拍精品露脸快速|
精品久久精品|
欧美视频日韩电影|
黄色网站久久免费看|
三级片的网址在线免费观看|
免费无码又爽又刺激高潮视频男
|
污视频免费久久免费|
91久久久久久亚洲精品|
欧美精品v国产精品v曰韩精品|
亚洲天堂久久精品尹人一区二区|
国产v综合v亚洲欧美|
劲爆欧美 亚洲 一 区三区|
欧美一级片在线观看国产一级黄片|
337p69日本欧洲亚洲大胆艺术|
手机午夜激情影片在线播放网站|
日韩中文字幕在线专区|
黑丝袜污视频在线观看|
国产精品裸体美女网站|
中文字幕亚洲一区二区三区5566|
深夜网站免费观看|
国产欧美亚洲精品第二区软件|
免费看黄色a级大片|
成人免费电影亚洲|
欧美大尺度做爰啪啪床戏片段|
亚洲国产91麻豆|
欧洲人曰b大全视频|
成 人免费va视频无码|
久久亚洲精品国产午夜福利|
污黄黄色毛片网站在线观看|
国产日本韩国91|
国产亚洲网站在线播放|
欧美丰满熟妇久久久96喷水|
国产ar高清视频+视频|
亚洲主播在线视频|
3344在线观看无码不卡|
AⅤ人妻中文无码视频|
欧美日韩中文字幕在在线视频|
国产精品成人超碰97|
亚州国产精品女人视频久久久|
2022AV高清国产天堂免费视频|
日韩女同在线一区二区|
丝袜老师里面好紧水好多|
亚洲一区二区九一视频|
惠民福利国产群交轮流内射骚|
亚洲av中文无码字幕色最新|
91短视频下载污|
欧美视频免费高清在线观看
|
天天狠狠色综合图片区|
国产在线播放人午夜|
精品国产亚洲美女久久久|
少妇与子乱在线观看|
中文字幕手机精品免费视频|
亚洲欧美激情另类视频|
日本H熟肉动漫视频在线观看|
日韩免费a级毛片无码a∨|
仑乱老女人在线观看|
国产精品久久久久久无码一区二区
|
女生和男生一起怼怼怼的游戏|
动漫精品无码精品一区二区|
久久久久中文无码精品|
久久久久无码精品亚洲A∨
|
国产自无码视频在线观看手机|
国产精品午夜视频免费|
中年熟女精品视频免费播放|
噜噜噜视频在线观看|
久久亚洲精品国产午夜福利|
日韩精品在线观看视频|
天天狠狠色综合图片区|
欧美成人高清在线视频大全|
欧美图片电影天堂|
免费的成人一级毛片|
亚洲欧美另类bt自拍区图片|
久久九九机热国产精品|
污视频免费久久免费|
亚洲欧美自拍另类日韩|
无码纯肉视频在线观看免费|
999福利激情视频|
国产精品白浆流出在线观看|
茄子短视频看黄专用|
91久久精品曰曰躁夜夜躁国产|
亚洲国产婷婷综合在线|
亚洲美女午夜福利视频|
制服丝袜中文字幕在线看网址|
国产在线bv视频在线播放|
午夜免费av在线|
艳妇雪白细嫩的艳妇|
自拍影视综合欧美|
人妻精品久久久中|
AV每日资源中文字幕|
k频道国产网红欧美在线视频|
中文字母AV一区二区三区|
AV每日资源中文字幕|
高清AV一区二区三区|
体育生自慰gaychinesevideo|
男女后进式猛烈XX00免费动态图|
亚洲成a人片在线观看中文!!!|
国产在线一区二区91|
丰满少妇高潮抽出直播|
国产成人无码小说在线观看|
男女无套免费网站国产|
打扑克又疼又叫直播软件下载安装|
九九热国产视频精品|
免费高清无码在线观看|
精品丝袜国产在线精品不卡|
粗大猛烈进出高潮喷浆h|
日韩二区成人在线|
小草影院在线观看视频播放|
在线 不卡 免费 欧美|
手机中文字幕在线视频|
欧美国产图片视频小说|
性欧美大屁股xxxx|
亚洲美女午夜福利视频|
美女香蕉视频在线|
日本视频网站在线www色|
免费看欧美日韩综合国产成人一区二区三区
|
自拍偷拍 亚洲|
精品视频在线视频观看
|
99RE6热视频这里只精品首页
|
不卡中文1区2区|
亚洲AV无码AV吞精久久久|
成品网站W灬源码1688伊|
国产丰满无码视频|
青青河边草在线观看免费视频|
无码专区在线97|
久久国产资源福利网站|
欧美亚洲国产一区在线观看99国产黄色視頻网站|
亚洲国产欧美高清在线|
超碰在线观看网址|
五月天婷婷性爱视频|
国产目拍亚洲精品二区蜜芽|
亚洲gv无码成人污在线观看|
日韩av三级电影|
亚洲激情一级黄片|
免费啪视频一区二区三区|
av毛片色一区在线|
国产精品视频一区久久|
荔枝成人免费视频观看|
日韩福利写真不卡手机在线|
欧美女人91成人网|
国内自拍网站在线播放|
久久91亚洲精品|
国产精品无码电影院|
国产精品自拍视频资源|
国产美女精品自在线拍电影|
国产97人人超碰Cao蜜芽|
又硬又粗又黄的视频网站|
免费大片一级一级久久|
少妇美女久久久久久|
成人无码a∨在线观看免费
|
国产精品点击进入在线影院|
午夜福利视频三级|
星空传媒视频在线观看|
1024日本有码合集|
99精品亚洲美女久久久久|
欧美日韩女优在线视频|
国产精品亚亚洲AV|
18款夜间禁用软件下载网页|
超碰在线观看网址|
亚洲人妻在线视频最新|
六月天丁香婷婷|
在线视频一区日本韩国|
自拍偷拍 亚洲|
国产精品色午夜视频免费看|
欧美特黄网站在线观看婷婷
|
中文字幕国产区免费|
精品2020亚洲日本免费|
亚洲av无码久久精品蜜桃播放
|
国产一区亚洲二区三区|
少妇无套内射免费观看视频|
亚洲午夜熟女av电影|
亚洲三区 精品视频|
精品久久久看视频|
欧美国产图片视频小说|
亚洲中文国产天美88av骚女|
惠民福利国产群交轮流内射骚|
少妇与子乱在线观看|
2020国产精品视频|
久久v 国产综合色|
加勒比欧美激情欧美精品一区二区
|
亚洲自拍偷拍第一页|
人妻暴雨中被强制侵犯|
538prom国产一区二区三区
|
久久国产精品午夜激情在线播放|
亚洲精品电影在线观看|
色色网的五月天|
亚洲无码精品Av在线|
欧洲日韩二区精品视频
|
久久精品无码一级A片正在播放|
鲁鲁网亚洲站内射污污污视频片|
在线观看免费视频精品|
狠狠干影视三级片|
日韩视频一区二区在线视频|
欧美精品一级视频在线观看|
美女香蕉视频在线|
孕妇奶水仑乱A级毛片在线播放|
美女扒开奶罩露出奶头视频网站|
97国产资源总站在线|
亚洲精品欧美二区|
亚洲熟妇无码āV在线播放|
8888国产精品视频|
中文字幕日本αv一区二区|
综合一区二区国产欧美亚洲|
丁香五月深爱激情亚洲一区|
国产精品女上位高潮视频|
日韩亚洲中文字幕在线永久观看|
亚洲性夜夜综合久久麻豆
|
麻豆亚洲āv永久无码精品久久|
国产一区二区fc2ppv在线播放|
国产超级乱淫视频播放免费|
国产成人毛片无码视频1080P|
导航一区二区福利利|
欧亚乱色一区二区三区|
国内爱妃视频在线精品一区網站|
免费高清特级毛片a片微信群|
青青草在久久免费久久免费|
手机在线观看你懂得|
超清制服丝袜无码αv福利网|
久久久久无码精品亚洲A∨
|
丁香六月亚洲婷婷|
美女裸体黄污18禁网站免费
|
国产重口另类极限扩张视频网站
|
99热九九热精品在这里做|
日本久久精品免费一区|
又爽 又黄 免费视频|
男人裸j照无遮挡男|
久久免费特黄视频|
国产jizz在线观看|
色视频线观看在线播放|
女人被狂躁c到高潮喷水一区二区
丰满人妻被义子侵犯中文字幕
|
成人午夜影院在线观看|
殴美女人色一区二区|
538prom国产一区二区三区|
在线观看无码免费视频网址|
国产精品a一区二区三|
一区二区国产日韩欧美综合|
久热精品在线视频观看国语|
国产av网址久久|
欧美日韩国产激情在线视频|
在线黄无码视频观看|
警花av一区二区三区|
天天操天天干天天玩|
女人19水真多免费毛片|
国产精品亚亚洲AV|
中文男女做性无遮挡免费视频|
在线看片免人成视频国产|
欧美日韩东京另类|
亚洲无码视频加勒比|
欧美mv日韩mv国产网址|
麻豆久久精品国产剧情|
国产精品欧美一区二区浪潮|
yellow字幕网在线zmzz91|
上司丰满人妻一级A片|
国产手机?V片在线无码观你|
国产片一级真人片视频|
成人午夜福利在线免费观看|
亚洲无码在线精品免费|
美女午夜激情免费福利视频|
国产精品扒开腿做爽爽爽色网视频|
亚洲国产日韩制服丝袜在线|
日日碰狠狠丁香久燥|
国产精品久免费的黄网站|
国产精品三p一区二区三区视频|
精品欧美成人高清不卡在线观看|
色就是色亚洲视频|
孕妇奶水仑乱A级毛片在线播放|
67194新熟女免费|
亚洲欧美经典国产|
红桃视频在线观看一区二区|
我半夜帮妺妺洗澡c了她软件|
日韩在线第一页播放|
娇妻互换享受高潮|
成人激情在线|
国内自拍网站在线播放|
国内精品日韩一区二区三区|
96人人人爽爽爽|
亚洲韩国国产AV|
鲁视频啊鲁鲁吧在线|
精品剧情V国产在线观看|
精品视频国内精品视频在线|
亚洲欧美日韩国产成人精品|
欧美日韩国产在线va|
国产乱了真实在线观看|
欧美男女操逼免费网址|
欧洲最新在线黄色网址|
大日韩女大片一级|
啦啦啦www在线观看免费|
成人黄色网址大全|
国产野战无套av毛片|
国产精品99国产精品99|
女人19水真多免费毛片|
久久久久极品av无码中文字幕|
国产在线看不卡|
欧美男女操逼免费网址|
亚洲毛片无码专区亚洲|
成人羞羞视频在线观看男生|
日本黄页大全免费|
亚洲一区二区精品动漫最熱門最齊全電影!
|
亚洲欧洲日产国码av系列|
成人激情在线|
国产一级a作爱片全过程片52|
免费高清在线观看a片|
久久久精品动漫|
91香蕉视频在线观看久久免费|
天美麻花果冻苏蜜清歌|
欧美一区二区三区黄色片|
成人午夜福利在线免费观看|
亚洲аv电影天堂网|
被老头一个晚上做了6次|
免费观看一级电影在线|
高清精品无码在线观看|
国产理论精品一区二区|
色婷婷亚洲婷婷五月小说专区|
无遮挡十八禁污污网站在线|
免费综合久久亚洲|
青青青草原亚洲综合|
久久免费黄片a级|
免费特级一级作爱片|
日韩亚洲中文字幕在线永久观看|
色戒完整高清一区二区三区|
99热只有这里有99精品|
91香蕉视频在线观看久久免费|
麻花豆传媒MV在线观看软件|
在线观看污片|
久久上司侵犯部下人妻|
久久久特级无码AV二区免费看|
亚洲图片在线|
欧美亚洲日韩国产综合91|
男人的天堂久久精品激情a|
人妻互换一二三区激情电影|
成人 国产 免费|
加勒比无码一区人妻|
亚洲性夜夜综合久久麻豆
|
国产精品va无码一区二区在线观看|
国产在线四虎tv社区|
日本人妻熟妇一区二区aPP|
中日韩欧美美女在线观看一区|
在线看片免人成视频国产|
亚洲一级大黄大色毛片www|
差差差30分钟免费下载软件大全|
久久中国国产av|
涩悠悠狠狠干|
国产野战无套av毛片|
亚洲国产日韩制服丝袜在线|
无码人妻厨房色诱中文字幕|
久久99人妻精品涩爱噜噜噜蜜臀|
国产在线播放人午夜|
久久久久免费试频|
自拍欧美一区精品国产|
欧美资源在线一区二区三区|
国内女人自慰一区二区三区|
加勒比欧美激情欧美精品一区二区|
久草色网视频免费在线观看|
日韩亚洲综合精品国产|
亚洲舒服久久精品动漫321|
久久久久中文无码精品|
A久久精品国产精品|
成视频年人免费看黄网站|
人妻无码二区自慰系列|
欧美成人香蕉网在线观看|
无码一级午夜福利|
国产精品麻豆AR影院|
日韩亚洲看高清无码|
亚洲日韩精品?∨片无码加勒比|
亚洲国产欧美日韩综合专区|
成人精品一区二区三区中文|
无码人妻av一区二区三区av|
日韩午夜中文字幕|
国产加勒比无码视频在线|
国产亚洲欧美另类中文91|
国产绳艺在线精品系列|
久久久久人妻无码视频|
成人免费观看三级毛片|
亚洲自拍偷拍第一页|
4480yy亚洲成年私人影院|
国产亚州制服高清版|
能够直接看的无码AV|
国产精品久久电影网|
玩弄chinese丰满人妻|
国产另类重口视频|
精品国产污电影在线观看|
一级毛片在线免费观看视频|
日韩亚洲另类专国产区|
中文在线日韩乱码不卡视频
|
一本日本在线视频免费播放|
男女无套免费网站国产|
极品少妇高潮到爽|
亚洲殴美在线视频|
中文字幕有码免费一区二区|
亚洲免费无码|
米奇影视四色777|
青青青草原亚洲综合|
中国老熟妇牲交大全视频中文|
国产精品无码无套在线|
么公午夜在线播放视频|
大美女啪啪污污网站|
色色wc无码夜夜|
国产欧美美女精品自拍酒店午夜一区
|
欧冬日韩国产精品|
99国产午夜精品|
亚洲毛片一区二区无卡午|
精品人妻人妻人一区二区有限公司|
重口一区在线观看|
男人扎爽进女人j羞羞漫画
|
国产精品一区二区av白丝在线|
日韩黄色熟女视频|
欧美国产影院|
亚洲女人被黑人巨大猛进|
亚洲色区一区|
欧美在线一级a级在线视频|
成 人 黄 色 免费 网站|
美女全婐网站免费视频|
少妇偷人精品视频免费|
国产毛片健身在线|
国产 免费 无码精品|
制服丝袜中文字幕久久一区|
色综合久久天国91精品|
鲁鲁网亚洲站内射污污污视频片|
亚洲人成A在线播放|
亚洲天堂2024无码|
日本亚洲欧洲免费中文字幕|
欧美极品视频在线|
日韩精品成人网页在线观看免费|
日本高清不卡码中文字幕|
91精品人妻一区二区三区蜜桃臀|
日韩无码免费网站AV|
在线日韩成人电视免费观看视频|
伊人久久大香线蕉综合07|
日本女性性爱一区二区三区|
老爷含着春桃的奶头|
欧美成人www在线又观看直播|
男子午夜精美亚洲永久av|
亚洲毛片精品一区二区|
日韩AV丝袜一区二区在线观看|
天天艹天天射|
亚洲成a人片在线观看国产不卡
|
国产精品视频一区久久|
人成视频在线观看免费国产|
日本韩国在线一区二区|
久久99精品成人免费毛片|
爽灬爽灬爽灬毛及a片|
精品亚洲成?人片在线观看|
韩国一级黄片日逼片|
欧美一级A片视频免费播放久久|
无码人妻厨房色诱中文字幕|
成熟日本语热亚洲人|
老师脱了内裤让我进去|
色就色欧美综合在线影院|
国产波霸爆乳一区二区精品|
中文字幕丁香五月天|
美妇天天干天天操|
国产白浆视频在线播放|
国产成人ae在线观看网站站|
日本三区四区免费高清不卡|
欧美专区日韩高清|
成品禁用app漫画i|
国产亚洲欧洲在线成人|
一区二区三区在线有码视频
|
欧美在线观看免费专区|
欧美一级黄色18片免费看|
国产二区精品福利|
五月婷婷视频二区|
亚洲av成人无码一区二区三区在线观看|
精品小视频在线观看|
亚洲无码毛片免费视频在线观看
|
1314国产爆乳无码邻居|
果冻传媒乱码一区|
亚洲免费无码|
67194新熟女免费|
AV每日资源中文字幕|
中文免费看精品黄色视频|
军人粗大的内捧猛烈进出视频|
一区二区三区午夜电影院|
影音先锋无码资源男人网|
人妻聚色窝人体www|
国产成人年无码片在线观看|
午夜在线一区二区三区|
欧美亚洲综合另类无码天狼影视|
国产av无码专区亚洲av麻豆|
国产高清无码一区三区二区|
99国产精品白浆无码流出|
亚洲大成色www永久网址|
日韩超级大片免费看国产国产|
人人妻人人澡人人爽欧美一在内谢|
國產精品自拍偷拍視頻|
日韩av三级电影|
日韩旡码视频免费观看|
久久无码高潮爽到爆的喷水视频|
超清制服丝袜无码αv福利网|
亚洲av中文无码字幕色最新
|
久久精品国产对白国产av粉色
|
视频黄页在线观看|
高清在线观看一区亚洲|
亚洲无码 ?V 在线|
粉嫩小仙女高潮喷白浆视频
|
亚洲卡通高清无码动漫不卡|
欧美人与动牲交AⅤ|
老爷含着春桃的奶头|
国产a刺激v视频刺激|
欧美国产日韩va另类|
国产精品午夜视频免费|
人妻有码ΑV中文字幕久久琪琪布久久少妇视频
|
美丽姑娘高清版在线观看免费中文
|
上司丰满人妻一级A片
|
久久女自慰喷潮www免费网站
|
手机免费看国产黄色片|
麻豆视频高清无码在线观看|
亚洲精品无码九九九九九|
日韩电影无码一区二区三区|
色黄国产午夜精品久久久久久|
亚洲成人黄色三级|
精品2020亚洲日本免费|
天天躁日日躁狠狠躁网站|
一起草成人免费AV|
人妻有码ΑV中文字幕久久琪琪布久久少妇视频
|
亚洲乱熟女av一区二区三区|
歐美日韓一區二區在線播放|
91短视频下载污|
国产免费天天看高清影视在线|
成人 国产 免费|
又粗又黄又硬又爽免费视频|
亚洲日韩欧美一区久久久我|
114A一级毛片免费|
午夜国产理论在线|
日韩精品欧美视频在线观看|
体育生自慰gaychinesevideo|
97久久精品无码一区二区天|
成人性三级在线视频|
2020国自产拍精品露脸快速|
欧美日韩免费一级毛片|
免费看欧美日韩综合国产成人一区二区三区
|
国产精品先锋资源站先锋影院|
日本美女18禁网站免费观看|
国产精品va无码一区二区在线观看|
91成人在线免费观看|
337p欧洲亚洲日本大胆色噜噜|
国产目拍亚洲精品二区蜜芽|
国产一区二区日韩欧美|
欧美丰满熟妇久久久96喷水|
成年人色色免费电影|
亚洲岛国日韩欧美在线v|
青青草99热这里都是精品|
a97se亚洲国产综合自在线|
久久精品国产欧美激情久久|
在线免费观看黄色网站|
香蕉在线凹凸分类视频|
国产ssss在线观看极品|
日本美女三级视频九九九|
福利小视频在线观看|
午夜激情免费大片|
欧美成人高清在线视频大全|
亚洲老司机深夜私人影院|
久久久人成精品色欲av鲁丝片|
欧美乱伦国产中文|
91国内精品人妻无码久久久|
久久SE精品一区二区|
国产不卡一卡2卡三卡4卡5卡在线|
国产成人一区二区在线播放|
免费三级亚洲人成|
一区二区av强奸无码av|
аⅴ天堂中文在线18|
亚洲美女在线国产|
国产一区亚洲二区三区|
亚洲美女爽爽爽爽爽爽爽爽|
强制高潮18XXXX按摩它|
国产自无码视频在线观看手机|
人妻熟妇乱又伦精品hd|
黄色成人网站免费无码av在线播放|
91成人超碰在线观看|
欧冬日韩国产精品|
国产亚洲精品a在线看|
美女黄色网站在线观看的|
2021国产丝袜在线观看|
欧美18精品久久久无码毛片a片麻豆|
国产一国产一级毛片视频|
成 人 黄 色 免费 网站|
啦啦啦www在线观看免费|
亚洲欧美另类bt自拍区图片|
五月天国产在线无码视频|
国产成人av专区|
99久久国产综合精品网成人|
日韩精品另类无码免费观看|
日本视频在线观看免费|
国产三级在线线看免费|
亚州国产精品女人视频久久久|
红桃高清在线播放免费观|
国内视频精品极品在线播放|
国产亚洲欧美日韩在线播放|
色多多在线视频|
久久久噜噜噜久久69|
免费AV永久免费网址|
国产精品视频一区久久|
99久久999久久久综合精品|
国产欧美日韩亚洲精品小说|
亚洲福利小视频|
无码a√毛片一区二区三区视频|
亚洲人与动人物a级毛片一|
体育生喷汁高H呻吟男男视频|
国产免费A在线播放|
亚洲女人的天堂白慰|
丁香花视频资源在线观看免费|
亚洲国产午国产精品福利一区二区|
日韩在线视频一区二区三区|
亚洲热妇无码Av在线热播|
在线 不卡 免费 欧美|
欧洲人妻丰满aⅴ无码久久不卡了
国产亚洲欧美另类中文91
|
日韩黄色一级电影|
亚洲aⅤ成人一区二区三区天堂|
精品免费视频中文字幕2020|
国产强d在线播放免费|
99久久久精品视频观看|
十八禁网站动漫精品一区二区|
欧美 婷婷 一区|
久久精品国产对白国产av粉色|
久久完整一级a免费|
一级无码电影|
91自慰亚洲精品|
日本精品第一色网在线|
午夜免费啪视频观看网站|
色婷婷亚洲婷婷五月小说专区|
97久久婷婷五月综合色d啪蜜芽|
亚洲美女午夜福利视频|
97视频公开在线观看视频|
工口h无翼乌全彩之不知火舞|
欧美午夜一区在线欧美亚洲|
亚洲欧美国产精品一区二区综合精品区
|
特黄特色的国产三级精品|
網友分享国产区网址心得
|
中国老熟妇偷拍视频|
亚洲精品人成网在线播放蜜芽|
亚洲午夜视频体内射|
在线看片av网站不卡的|
无遮挡无掩盖的网站|
性一交一乱一伧一小说有声|
婷婷国产综合精品|
国产成人ae在线观看网站站|
国产精品亚洲一级AV第二区|
精品久久久久九九九九国产潘金莲|
久久精品国产国产精品四凭|
正在播放国产国语在线精彩视频|
轻轻的挺进少妇的体内|
欧美老妇XXX午夜福利|
国产日本一区二区三区视频|
91麻豆精品在线播放|
欧美成人在线免费观看|
洗濯屋+无码+迅雷|
福利一区在线视频播放|
国产精品爱赏网久久无码桃花|
久久精品一区二区三区不卡中文|
日本熟妇大屁股中文中出
|
免费看黄的软件|
日本熟人妻中文字幕在线app|
国产夫妻精品自拍|
8888国产精品视频|
激情小说五月天在线视频丁香|
高清欧美亚洲国产日本下载|
小莹的yin荡生活下视频|
色香一区二区视频|
国产精品成人精品一区二区|
狠狠干影视三级片|
久久九九免費視頻|
黄色成人网站免费无码av|
日韩欧美成人免费网站观看|
精品国产美女福利|
制服丝袜中文字幕久久一区|
亚洲国产aV无码AV一区|
女人裸体扒开下身照片无遮挡|
国产在线一区二区91|
国产成人精品高潮综合久久|
天天看无码av片|
一本色道无码在线观看|
亚洲欧美中文日韩视|
人人射人人澡|
日本中文字幕影片|
成人福利视频网站|
在线黄无码视频观看|
3d精品动漫在线一区二区三区
|
日本美女三级视频九九九|
自拍影视综合欧美|
爽爽婬人综合网网站無需任何下載
|
啪啪熟女免费视频|
亚洲中文字幕精品久久?pp|
一级a爱做片在线观看免费网站|
午夜无码国产视频|
手机在线国产精品|
影音先锋无码资源男人网|
国产97在线视频|
最近高清中文字幕大全1|
国产日韩产欧美一区二区|
影音先锋熟女少妇av资源|
国产亚洲av成人|
成年污片免费视频网站|
岛国片欧美一级毛|
精品日韩一区二区三区AV动图|
黄色成人网站免费无码av在线播放|
美女高潮视频无遮挡|
在线观看无码色网视频|
亚洲aⅤ成人一区二区三区天堂|
国产单亲L仑视频在线观看|
鲁视频啊鲁鲁吧在线|
a97se亚洲国产综合自在线|
婷婷丁香欧美在线综合一区|
免费福利小视频|
久久久午夜爽爽一区二区三区三州|
91久久人澡人妻人人做|
免费v片无码动漫在线观看网址|
小早川在线一区二区三区|
一区二区国产高清不卡线视频|
五月天国产在线无码视频|
欧洲人曰b大全视频|
中文免费看精品黄色视频|
青青青vip国产精品|
69精品久久日日躁夜夜躁|
中文无码熟妇人妻av|
国产精品久久黄色影院|
久草综合欧美|
国产乱伦日本中文|
99久久精品免费看国产免费|
国产 日韩 欧美 亚洲|
亚洲啪啪一区二区综合精品区|
国产女人被狂躁到高潮视频9|
午夜影院网站推荐|
中文字幕人妻乳一区二区三区四区
|
特黄特色的国产三级精品|
无码久久免费亚洲|
国产夜色快憣免费av|
亚洲人成A在线播放|
亚洲午夜无码专区在线观看|
日本免费夜色观看视频|
久久免费性爱电影|
毛片无码专区精品一区|
中文字幕自拍偷拍精品无码|
性欧美大屁股xxxx|
女人被第一次18毛片|
亚洲天堂网最新|
国产日日夜夜完整版视频|
av无码免费高潮喷水不卡|
欧美在线观看免费做受视频|
一本色道无码不卡在线观看|
上司丰满人妻一级A片|
免费高清无码在线观看|
中文啪啪网日本东京热|
爆乳裸体无码天堂AV白浆|
日韩国产综合欧美|
人妻放荡黄淑雅1—28|
国产精品久久久久天天影视|
国产日韩欧美有码|
精品视频国内精品视频在线|
日本高清www午色夜com|
日韩精品 国产av|
蜜桃无码成人一区在线视频|
后入翘臀少妇一区二区三区|
欧美亚洲精品邻居|
亚洲国产精品不卡在线播放|
成人无码a∨在线观看免费
|
正在播放国产尾随丝袜美女|
天天操天天干天天玩|
成人影片在线免费观看|
免费曰b爽爽爽爽看|
色l频道在线观看|
激情都市综亚洲精品综合|
日韩同性av无码片|
国产后入在线观看|
亚洲av秘片一区二区三光遇|
国产精品午夜宅男电影|
漂亮的保姆在完整5视频带翻译|
五月天丁香成人电影|
特黄特色的国产三级精品|
国内精品自在自线视频在线观看|
亚洲一本之道高清乱码|
野花社区视频www官网|
国产精品无码天天爽视频|
中文字幕视频三区在线观看
|
女自慰喷水精品www久久久|
日韩av一区二在线|
日本三级视频一区二区久久|
欧美精品v国产精品v曰韩精品|
亚洲国产91麻豆|
免费观看国产女人高潮视频在线高清|
亚洲老司机深夜私人影院|
久久99免费国产精品|
日韩做A爰片久久毛片A片小说
|
深夜免费a级毛片久久|
国产精品白嫩美女在线观看app|
亚洲毛片无码专区亚洲|
午夜无码在线免费网站|
午夜亚洲av永久无码精品动漫|
无码久久免费亚洲|
午夜无码在线免费网站|
久久亚洲视频手機看片影視網站
|
亚洲国产黄片亚洲性爱自拍|
久久美女国产视频|
人与动人物XXXX毛片∵丨6|
一本日本在线视频免费播放|
国产日本韩国91|
亚洲精品成人中文网|
亚洲午夜无码专区在线观看|
亚洲国产黄片亚洲性爱自拍|
热热久热中文字幕亚洲|
天天爽天天狠久久久综合|
亚洲一级在线播放|
亚洲女人的天堂白慰|
国产另类重口视频|
成人色欲久久久|
99久久999久久久综合精品|
草b视频在线免费观看|
勾搭那些事资源在线观看|
黑丝麻酥酥极品收藏白虎穴|
日韩不卡av在线播放探花|
欧洲日韩二区精品视频
|
99免费网站在线观|
欧洲人妻丰满aⅴ无码久久不卡了|
人妻精品久久久中|
日本一区二区三区中文字幕久久9999久久免费精品国产
|
日韩旡码视频免费观看|
中文字幕亚洲一区二区三区5566|
五级毛片亚洲欧洲综合网|
99精品亚洲美女久久久久|
欧美劲爆色情av播放|
精品午夜精品一区二区三区|
亚洲无码精品Av在线|
国产精品a一区二区三|
aⅴ网站亚洲国产中文小电影|
国产一区二区在线观看免费视频|
波多野结衣亚洲一区二区三区观看|
911精品在线观看|
5g影视大片天天免费观看|
美妇天天干天天操|
国产制服丝袜无码视频|
爱情岛网站亚洲禁18进入|
天干夜天干天天爽|
天堂一区二区在线观看|
亚洲色欧美性另类春色|
黑毛毛一区二区|
中文字幕精品亚洲一区不卡|
欧美丝袜精品久久中文字幕|
亚洲AV无码一区二区三区欢看
|
一本不卡视频在线观看|
日韩旡码视频免费观看|
国产精品丰满对白在线观看|
欧美日韩国产综合片区|
亚洲AV色综成人网在线看小说|
无码纯肉视频在线观看免费|
国产成人精品一二三区|
制服丝袜中文字幕在线看网址|
国内自拍偷区亚洲综合伊人|
国产精品亚亚洲AV|
男女啪啦啦超猛烈动态图|
超爽毛片国产精品久久|
五月婷av综合网色伊人苍井空|
亚洲天堂网最新|
久久国产破处视屏|
91精品人妻一区二区三区蜜桃臀|
狼人香蕉国产在线视频
|
国产精品成人精品一区二区|
午夜在线观看网站|
久久国产精品一区免费观看|
国产精品一av一免费|
九色成人蝌蚪电影在线|
美女全婐网站免费视频|
99国产精品尤物免费视频|
A级在线观看黄色片|
日本三级在线观看影院|
日韩女同在线一区二区|
警花av一区二区三区|
久久久综合少妇另类|
国产你懂的在线|
大胆日本一区二区三区在线播放
|
色婷婷aⅴ日韩一区二区三区|
亚洲欧美亚洲欧美|
久久精品不卡中文字幕|
国内精品自在自线视频在线观看|
日本69视频在线观看完整版
|
日本无码久久在线观看|
人人精品视频在线观看|
成人AV日韩一区二区在线|
精品999在线免费观看|
欧亚乱色一区二区三区|
漂亮的保姆在完整5视频带翻译
|
亚洲国产成人一区二区网站|
欧美国产图片视频小说|
久久爰www免费人成|
久久精品不卡中文字幕|
国产一级特黄无码视频在线|
午夜性无码视频无码|
一区二区三区四区高请无|
中文字幕久久久国产精品|
久久久噜噜噜久久69|
女人被狂躁c到高潮喷水一区二区|
国产av日韩a∨亚洲av电影|
国产∨亚洲∨日韩∨欧美∨综合在线|
日韩午夜中文字幕|
苍井空与两个黑人潮喷|
国产97在线视频|
日韩精品高清不卡一区二区|
打扑克又疼又叫直播软件下载安装|
深夜国产一区二区三区在线看|
轻轻的挺进少妇的体内|
精品人妻中文字幕无码色欲|
十八禁网站动漫精品一区二区|
日本精品自产拍在线观看中文|
亚洲av片无码久久尤物|
黄色三级片在线观看免费|
日韩av在线一区二区三区四区|
一级乱电影在线观看|
一级a做片 日韩理论片|
日本播放一区二区|
我的里面舒服吗小熊移植|
国产亚洲精品久久久久久床戏|
午夜福利免费在线观看国产|
大胆少妇久久无码|
又硬又粗又黄的视频网站|
欧美日韩成人在线乱码|
欧美一级理论在线观看|
亚洲中文字幕宗合网|
亚洲一区二区男同视频大全|
欧美一级黄色18片免费看|
手机国产乱子伦视频在线|
无码专区久久综合|
一区二区自拍偷拍欧美日韩综合|
漂亮的保姆在完整5视频带翻译
|
四虎国产精品欧美|
亚洲人成在线精品|
亚洲性日韩精品一区二区|
上海少妇搡BBBB|
久在线免在线观看视频|
網友分享91狠狠操心得|
在线精品国产自二区不卡|
麻麻被同学在客厅cao到爽|
国产色极品女人在线视频|
日韩一级AA大片免费视频|
色色wc无码夜夜|
欧美一级二级一区|
久久亚洲A∨成人无码国产电影|
網友分享91狠狠操心得|
国内自拍网站在线播放|
日韩一卡2卡3卡4卡2021免费观看国色天香
|
一本九中文字幕在线播放|
精品国产午夜福利757
|
国产免费av一区二区三区|
久久九九有精品国产百花影院|
成a人v欧美综合天堂|
黄色一级电影在线观看|
国产免费A在线播放|
好男人资源在线观看播放视频网|
精品视频免费日产一区|
999视频在线观看|
涩悠悠狠狠干|
五月花在线视频|
国产精品无码无套在线|
a级国产片在线观看|
精品久久久99大香线蕉|
日韩无码精品中文字幕|
成人午夜影院在线观看|
亚洲午夜视频体内射|
少妇偷拍私密SPA按摩|
国产a在亚洲线观看品善网
|
日韩在线观看视频网站一区二区不卡
|
高清欧美亚洲国产日本下载|
国产手交高潮视频网站|
免费观看毛片网站|
亚洲日韩三区四区在线|
久久爰www免费人成|
亚洲欧美亚洲欧美|
亚洲成a人片在线观看国产不卡
|
999视频大全日本欧美|